Прогностический фактор, летальность и выживаемость больных с опухолями области III желудочка после комбинированного лечения. Рис. Предоперационные КТ головного мозга. Клинические проявления опухолей iii желудочка
Ведущие специалисты в области нейрохирургии:
Редактор страницы: Семенистый М.Н.

Балязин Виктор Александрович
Балязин Виктор Александрович , Профессор, Доктор Медицинских наук, Заслуженный врач РФ, Отличник Здравоохранения РФ, Врач-нейрохирург, Заведующий кафедрой нервных болезней и нейрохирургии

Молдованов Владимир Архипович
Молдованов Владимир Архипович , Кандидат Медицинских наук, Врач высшей квалификационной категории, 35 клинического стажа

Савченко Александр Федорович
Савченко Александр Федорович , Кандидат Медицинских наук, Врач высшей квалификационной категории, Заведующий нейрохирургическим отделением БСМП№2
Мозговые желудочки, подпаутинное пространство и цистерны мозга в норме имеют определенные размеры, форму и положение (рис. 30). При опухолях мозга размеры, форма и положение этих полостей могут претерпевать различного рода изменения. Из них наиболее значительными и важными являются изменения желудочков.
Основными факторами, обусловливающими изменения желудочков и подпаутинного/ пространства с его цистернами, являются спинномозговая жидкость и масса опухоли. Они действуют в противоположных направлениях.
Опухоль, сдавливая тот или другой отдел желудочка, вызывает уменьшение размеров его, изменение его формы, положения. При локализации в больших полушариях опухоль нередко приводит к смещению всей желудочковой системы в противоположную сторону. Наоборот, спинномозговая жидкость, накапливаясь, вследствие затруднения оттока в одном из отделов желудочковой системы проксимально от места блокады ведет к увеличению размеров этого отдела.
С точки зрения изменения желудочковой системы опухоли головного мозга делятся на три группы: 1) опухоли задней черепной ямки, 2) опухоли больших полушарий мозга, 3) внутрижелудочковые опухоли.

При опухолях задней черепной ямки основным фактором, влияющим на боковые желудочки, является спинномозговая жидкость. Накапливаясь в результате затруднения оттока в III и боковых желудочках мозга, спинномозговая жидкость ведет к равномерному и значительному растяжению их. При этом увеличение размеров желудочков сопровождается изменением их формы - расширяясь, они приобретают более округлую форму. Деформации и смещению подвергается лишь IV желудочек. При локализации опухоли в переднем отделе задней черепной ямки сдавливается и деформируется также сильвиев водопровод. При опухолях больших полушарий основным фактором, влияющим на желудочки, является сама опухоль. Она сдавливает, деформирует и смещает боковые и III желудочки. Роль спинномозговой жидкости в этих изменениях желудочковой системы менее существенна.
Характер и степень изменений желудочков при внутрижелудочковых опухолях находятся в прямой зависимости от их локализации. Например, при опухоли III желудочка, вызывающей нарушения продвижения жидкости через него-, одновременно с изменением размеров и формы его возникает равномерное и симметричное увеличение боковых желудочков. При опухоли заднего рога изменения возникают главным образом в нем, в то время как в объеме и конфигурации остальных желудочков отклонения выражены сравнительно слабо.
Изменения желудочков в зависимости от локализации опухоли в основном сводятся к следующему.
Симметричное увеличение боковых и III желудочков типично для опухолей задней черепной ямки и для опухолей, развивающихся из шишковидной железы. Исключение составляют крупные опухоли полушарий мозжечка, которые, припод
нимая мозжечковый намет и сдавливая задний рог бокового желудочка соответствующей стороны, могут приводить к уменьшению размеров его и к смещению кверху.
Общее и равномерное увеличение боковых желудочков с одновременным заполнением опухоли III желудочка характерно для опухолей как самого этого желудочка, так и зрительного бугра, стенок воронки, гипофизарного хода, сдавливающих. его полость или врастающих в нее.
В начальных стадиях опухоли больших полушарий мозга сдавливанию, деформации и смещению в первую очередь подвергается тот отдел одноименного бокового желудочка, в области которого развивается опухоль: при опухоли затылочной доли - задний рог, височной - нижний, лобной - передний, теменной доли - средний отдел. По мере роста опухоль начинает оказывать влияние на положение и размеры как других отделов одноименного и III желудочка, так и на соответствующие отделы желудочка с противоположной стороны. В результате в далеко зашедших случаях одноименный желудочек представляется резко сдавленным и деформированным, а вся желудочковая система - смещенной в противоположную сторону. Смещение передних рогов в стороны и обычно вниз наблюдается при парасагиттальных опухолях лобных долей, а смещение их вверх и в стороны - при опухолях ольфакторной ямки, особенно если они растут в обе стороны от средней линии.
Изменению подвергаются также подпаутинное пространство и цистерны мозга. По мере увеличения объема мозга в результате внутренней водянки кора постепенно все больше и больше придавливается к внутренней поверхности твердой мозговой оболочки. Вследствие этого, наряду со сглаживанием извилин, наступает уменьшение глубины борозд, а подпаутинное
пространство фактически исчезает; мозг по вскрытии твердой мозговой оболочки представляется как бы сухим. При поверхностных опухолях больших полушарий описанные изменения подпаутинного пространства в первую очередь возникают в области расположения опухоли, а с дальнейшим повышением внутричерепного давления - в пределах одноименного, а затем и противоположного полушария.
По мере развития внутренней водянки мозга уменьшаются также и цистерны мозга, особенно расположенные супратенториально: интерпендункулярная, парахиазматическая и другие. При развитии опухоли в пределах цистерны последняя хотя и увеличивается в размерах, однако бывает заполненной опухолью. Например, большая цистерна мозга нередко полностью заполняется опухолью, исходящей из червя мозжечка, миндаликов его или опухолью IV желудочка, прорастающей в нее через отверстие Мажанди.
Описанные изменения полостей мозга были известны давно. Они особенно хорошо выступают на предварительно уплотненном мозге (до извлечения из полости черепа). Однако прижизненное распознавание этих изменений и диагностическое использование их стали возможными лишь после введения в практику неврологического учреждения контрастных методов исследования желудочковой системы.
Контрастные вещества вводятся или в субарахноидальное пространство (энцефалография), или в желудочек мозга (вентрикулография). Энцефалография и вентрикулография позволяют тщательно осмотреть желудочки, подпаутинное пространство и цистерны и определить их состояние. Выявляемые этими методами изменения полостей мозга являются исключительно важными, нередко наиболее ранними симптомами опухолей мозга.
Вентрикулография и энцефалография. Оба метода были введены в практику Дэнди (вентрикулография - в 1918 г., энцефалография - в 1919 г.). При первом методе контрастное вещество! вводится непосредственно в боковой желудочек мозга путем прокола его, при втором - в субарахноидальное пространство спинного мозга путем поясничного прокола или прокола большой (затылочной) цистерны мозга.
В нашей стране первыми пневмоэнцефалографию мозга стали применять Неменов, П. О. Эмдин (1921) и М. Б. Кроль, а первые специальные работы, посвященные этому вопросу, опубликовали А. И. Бакулев (1923), Брускин и Френкель (1925), Б. С. Розонов и С. А. Чугунов, Кожевников и др. Кожевников (1925) дал подробное описание субъективных ощущений, возникающих при энцефалографии, подвергнув себя этой процедуре с исследовательской целью.
Для пневмографии мозга обычно применяется воздух. Отдельные предложения заменить воздух другими газами (озоном, углекислотой, кислородом, азотом) и веществами (липиодолом, торотрастом) не нашли широкого признания.
Энцефалография производится больному, находящемуся в сидячем положении. Обычно воздух вводится путем поясничного прокола. Лишь отдельные авторы для этих целей пользуются цистернальным проколом. При этом способе требуются меньшие количества воздуха для заполнения желудочков, а сама процедура переносится больными легче. Опасность вклинивания содержимого задней черепной ямки в затылочную дыру, в связи с извлечением спинномозговой жидкости, при цистернальном проколе значительно меньше, чем при поясничном.
Но, наряду с этими положительными сторонами, цистернальный путь введения воздуха имеет и существенные отрицательные стороны. При опухолях головного мозга, особенно располагающихся в пределах задней черепной ямки, в большой затылочной дыре часто отмечаются значительные отклонения в топографических соотношениях: смещения продолговатого мозга, сдавление его миндаликами мозжечка, втискивающимися в затылочную дыру, заполнение опухолью или образованиями мозжечка большой цистерны. Поэтому при использовании цистернального прокола для энцефалографии возможны ранения перечисленных выше образований мозга с катастрофическим исходом. В связи с этой опасностью энцефалография цистернальным путем, как правило, не применяется отечественными невропатологами и нейрохирургами.
Относительно вопроса о том, какой боковой желудочек и какие рога его необходимо пунктировать, следует придерживаться следующего принципа: пунктировать рог, наиболее удаленный от места предполагаемой локализации опухоли, например, при подозрении на опухоль лобной доли -задние, затылочной доли - передние рога. При подозрении на локализацию опухоли в задней или на основании средней черепной ямки можно производить пункцию любого бокового рога. У детей до заращения родничка целесообразно пунктировать через него передние рога.
Энцефалография и вентрикулография имеют свои показания и противопоказания.
Энцефалография имеет перед вентрикулографией следующие преимущества: она технически легко выполняется, при ней не требуется никаких специальных оперативных вмешательств. При использовании этого метода отсутствует опасность ранения иглой какой-либо крупной артериальной веточки, что иногда может иметь место при пункции мозга для вентрикулографии. При энцефалографии заполняются воздухом не только боковые и III желудочки, но и субарахноидальное пространство и цистерны мозга. Таким образом, этот метод дает возможность получить данные для суждения о состоянии всех ликворсодержащих пространств головного мозга.
По, наряду с этим, энцефалография имеет и отрицательные стороны. При опухолях задней черепной ямки, а также при супратенториальных опухолях со значительным повышением внутричерепного давления применение пневмоэнцефалографии опасно, так как может произойти вклинивание содержимого задней черепной ямки в затылочную дыру или височной доли в щель Биша и в отверстие мозжечкового намета. Механизм и причины возникновения этих опасных для жизни осложнений описаны выше. Поэтому в указанных случаях пневмоэнцефалография является противопоказанной.
Вентрикулография может быть применена во всех случаях, когда противопоказана пневмоэнцефалография: при подозрении на опухоль в задней черепной ямке, при закрытых формах гидроцефалии и вообще при сколько-нибудь значительном повышении внутричерепного давления. Она позволяет, однако, выявить только III и боковые желудочки. Выполнение ее несколько сложнее, чем энцефалографии, так как требует наложения трепанационных отверстий.
Каковы же должны быть объемные соотношения извлеченной спинномозговой жидкости и введенного воздуха?
Прежде считалось, что воздуха должно быть на 5-10%, меньше, чем выпущенной жидкости. Предполагалось, что воздух комнатной температуры, введенный в. желудочки, где температура выше, расширяется и занимает больший объем. Но при этом упускалось из виду, что воздух вследствие повышенного давления внутри желудочков сжимается. Помимо этого, следует считаться с возможностью утечки воздуха при недостаточно хорошо пригнанном поршне шприца.
В настоящее время признается более правильным вводить воздуха на 10-15%, больше, чем выводимой жидкости. Практика показывает, что при таких соотношениях количеств воздуха и спинномозговой жидкости заполнение желудочков оказывается более совершенным, а сама процедура переносится больными легче (А. И. Арутюнов, наши наблюдения и др.).
Правильно производимая пневмоэнцефалография не только помогает уточнить диагноз опухоли, но в отдельных случаях дает возможность ответить на вопрос, имеется ли в данном случае заболевания мозга опухоль или близкий к ней по характеру. Приводимые пневмоэнцефалограммы иллюстрируют значение пневмоэнцефалографии для общей и топической диагностики опухолей мозга.
В первое время после появления вентрикуло- и энцефалографии некоторым невропатологам и нейрохирургам казалось, что они делают ненужным детальное клиническое обследование больных с подозрением на опухолевое заболевание мозга. Так, Кушинг писал: «Вентрикулография по Дэнди настолько облегчает локализацию опухоли, что нет надобности в неврологическом обследовании». Однако накопление материала показало поспешность и ошибочность таких выводов. Оказалось, что оба метода, помимо некоторой опасности для жизни больного, во-первых, далеко не всегда дают возможность выяснить, лежит в основе обнаруженных изменений ликворсодержащих систем головного мозга опухоль или какой-либо другой процесс, например, арахноидит, при локализации его в задней черепной ямке; во-вторых, общедиагностические и топические заключения, которые делаются на основании пневмоэнцефалограмм, в 3-4%’ случаев расходятся с истинным диагнозом; в-третьих, при незначительных уклонениях от нормы, как и при любом другом методе обследования, становятся допустимыми различные толкования.
Помимо этого, чтение пневмоэнцефалограмм требует большого опыта, а методы введения воздуха и последующего обращения с больными, для обеспечения равномерного распределения его, - строгого соблюдения ряда правил; в противном случае появится возможность ошибочных заключений.
Поэтому большинство невропатологов и нейрохирургов рассматривает вентрикуло- и энцефалографию как весьма важные, иногда решающие, но в основном все же подсобные диагностические мероприятия при распознавании опухолей головного мозга.
Попытку зарубежных авторов заменить при опухолях мозга детальное неврологическое обследование пневмоэнцефалографией мы считаем необоснованной и неправильной также и в силу следующих соображений. Вопрос о том, применить ли в данном конкретном случае опухолевого заболевания мозга энцефалографию или вентрикулографию (а если использовать последнюю, то через какие рога), решается лишь на основании того, в каком месте предполагается опухоль (суб- или супратенториально, в лобной или затылочных долях и т. п.). Ориентировочная диагностика и приблизительное установление локализации опухоли возможны лишь при неврологическом обследовании.
Тщательное общесоматическое и неврологическое обследования больных необходимы еще и потому, что пневмоэнцефалография, дающая возможность выявить изменение желудочковой системы, в большинстве случаев не определяет характера процесса (обусловлено ли это изменение, например, мультиформной глиобластомой, астроцитомой, раком, абсцессом, солитарным бугорком и др.). Распознавание природы процесса, вызывающего деформацию и смещение желудочковой системы, возможно лишь на основании данных общесоматического и неврологического обследования, в том числе и тщательно собранного анамнеза.
Пневмоэнцефалография при опухолях мозга тягостна для больных, а при наличии значительного повышения внутричерепного давления и при некоторых локализациях опухоли может представлять некоторую опасность для жизни. Правда, последние годы риск, связанный с применением этого метода, уменьшился в связи с уточнением показаний к нему и усовершенствованием методики выполнения. Так, в сборной статистике Гранта (1932), основанной на данных применения вентрикулографии у 392 больных, смертность достигала 8,2%, по Венсану (1935), из 250 больных, у которых было произведено исследование по этому методу, погибло 2%, а по де Мартелю- 1,3%. Смертельные исходы в связи с вентрикулографией у больных, находившихся под нашим наблюдением в последние годы, составляют также 1,3%.
Весьма важное значение для снижения опасности, связанной с вентрикулографией, имеет последующее ведение больных. В настоящее время всеми считается необходимым после производства вентрикулограмм или выпустить из желудочков воздух, или при подтверждении диагноза и уточнении локализации опухоли немедленно оперировать.
Значение последнего обстоятельства иллюстрируют данные Венсана. Из 250 вентрикулографий при внутричерепных заболеваниях, протекающих по типу опухоли (у 71 больного наличие опухоли не было подтверждено), он имел 5 случаев (2%) смертельных исходов. Эти исходы, как показывает анализ, находились в зависимости от того, предпринималось ли после вентрикулографии оперативное вмешательство и если оно было, то через какой срок. Так, из 91 больного, которым производилась пневмовентрикулография, но операции не применялось или она делалась спустя 4-12 и более часов, погибло 4 человека (4,4%) из 159 больных, которым оперативное вмешательство производилось в первые 3 часа после вентрикулографии, умер всего лишь один (около 0,7%).
Энцефалография гири введении воздуха посредством поясничной пункции сама по себе менее опасна, чем вентрикулография. Смертность при применении ее значительно ниже. По Пэнкосту и Фаю (Pancoast и Fay), из 1 529 больных, которых исследовали с помощью этого метода, погибло 1,2%. Но у этих больных были не только опухоли и опухолеподобные заболевания мозга, но и другие заболевания. При опухолях же, особенно задней черепной ямки, энцефалография представляет большую опасность, чем вентрикулография.
В Ленинградском нейрохирургическом институте имени А. Л. Поленова за период с 1935 по 1948 г. из 106 больных, которым была произведена энцефалография при опухолях мозга, также погибло двое. Оба эти больные исследовались в первые годы применения энцефалографии, когда противопоказания к ней еще не были уточнены. Случай смерти в связи с энцефалографией описывали А. И. Арутюнов и др.
Анализ показал, что энцефалография особенно опасна при опухолях мозжечка, III и IV желудочков мозга, височной доли, в особенности в той стадии их развития, когда наступает блокада ликворовыводящих путей.
Большинство невропатологов и нейрохирургов считает, что при подозрении на локализацию опухоли в пределах задней черепной ямки энцефалография поясничным путем вообще не должна применяться. Мы считаем возможным ее использование при условии, если отсутствуют застойные соски. Исключение мы делаем только для больных, у которых подозреваем опухоль или цистицерк IV желудочка, обладающие большой смещаемость и при выраженном синдроме Брунса. В этих случаях и при наличии застойных сосков мы прибегаем к вентрикулографии.
При супратенториальных опухолях мы считаем возможным применять энцефалографию не только при отсутствии застойных сосков, но и при начальных стадиях развития их. Исключение в последнем отношении мы делаем только при подозрении на локализацию. опухоли в височной доле, особенно в ее глубинных отделах. При выраженных стадиях развития застоя сосков зрительных нервов мы прибегаем к вентрикулографии, независимо от предполагаемой локализации супратенториальной опухоли.
Наиболее частой причиной смертельных исходов при энцефалографии является вклинивание миндаликов в затылочное отверстие со сдавлением продолговатого мозга или вклинивание височной доли в вырезку мозжечкового намета со сдавлением мозгового ствола и последующим его- отеком. Случаи вклинивания этих образований после энцефалографии, приводившие к смерти, описывались неоднократно. Чем выше внутричерепное давление и чем более продолжительно оно, тем опаснее энцефалография, а в некоторых случаях и вентрикулография.
По мере повышения внутричерепного давления жизненно важные центры (дыхательный, сердечно-сосудистый) постепенно приспосабливаются к функционированию в новых для них условиях. Острое изменение этих условий может привести к истощению и параличу этих центров. В частности, подобное изменение этих условий может иметь место при извлечении спинномозговой жидкости при производстве пневмоэнцефалографии, в особенности, когда опухоль локализуется в задней
Черепной ямке. Извлечение спинномозговой жидкости может вести к вклиниванию содержимого этой ямки (имеющейся здесь опухоли или миндалин мозжечка) в большое затылочное отверстие, а при локализации опухоли в средней черепной ямке или в больших полушариях - к вклиниванию гиппокамповой извилины височной доли в отверстие мозжечкового намета. Результатом этого вклинивания являются: 1) усиление блокады ликворопроводящих путей, которое ведет к дальнейшему острому нарастанию внутричерепного давления; 2) прямое давление вклинившегося содержимого задней черепной ямки на жизненно важные центры, расположенные в продолговатом мозгу; 3) нарушение проведения корковых импульсов, регулирующих функции дыхательного и сердечно-сосудистого центров, вследствие вклинивания сосудистого центра.
В результате сочетанного действия этих патофизиологических механизмов после извлечения спинномозговой жидкости остро создаются новые неблагоприятные условия для функционирования дыхательного и сердечно-сосудистого центров. Последние, не успевая приспособиться к этим новым условиям, подвергаются истощению и параличу.
При коматозном состоянии противопоказана и пневмоэнцефалография, и вентрикулография. С целью выведения больного из этого тяжелого состояния должна быть экстренно произведена разгрузка желудочковой системы путем извлечения спинномозговой жидкости через прокол бокового желудочка, в ряде случаев это мероприятие весьма эффективно.
Таким образом, пневмоэнцефалография должна применяться в первую очередь в начальных стадиях опухолевого заболевания головного мозга. Поэтому в тех случаях, когда всестороннее неврологическое обследование и простая краниография не дают данных для общей и топической диагностики опухоли, нельзя выжидать появления «убедительных» симптомов, а необходимо производить пневмоэнцефалографию. Этим самым будет снижена опасность применения данного метода и достигнута более ранняя диагностика - обстоятельство, имеющее столь важное значение для результатов последующего оперативного вмешательства при опухолях мозга.
Мы широко применяли пневмоэнцефалографию при подозрении на опухоль головного мозга. Так, за период с 1935 по 1948 г. из 613 пневмоэнцефалографий, примененных нами в Нейрохирургическом институте имени А. Л. Поленова, 48,4% были произведены для выяснения диагноза опухоли мозга. При достаточно отчетливой клинической картине опухолевого или опухолеподобного заболевания мы обычно не прибегали к этому методу исследования. Так, за тот же период из 679 больных с опухолями мозга, подтвержденными на операции или на секции, пневмоэнцефалография была произведена в 35,8%, а при абсцессах (87 больных), в том числе и травматических, в 50%. Правда, в случаях, когда больные с опухолью мозга находились в тяжелом состоянии, мы не прибегали к пневмоэнцефалографии и диагноз устанавливали только на основании данных неврологического обследования. В части случаев он оказался ошибочным.
Приведенные цифры частоты применения пневмоэнцефалографии не являются характерными; одни авторы используют ее очень широко, почти всем больным, другие - только 10%.
Пневмоэнцефалография должна назначаться только тем больным, у которых всестороннее клиническое обследование и обычная краниография не доставляют убедительных данных для общей и особенно топической диагностики опухолевого заболевания. Лично мы придерживаемся указаний Венсана применять ее, если: 1) существует неуверенность относительно наличия опухолевого заболевания мозга, 2) неясна локализация опухоли и 3) если введение воздуха не ухудшит состояния больного; отказываться от применения ее, если: 1) общая и топическая диагностика опухоли ясны и 2) опухоль видна на краниограмме. Мы следуем также положению Н. Н. Бурденко: «Недопустимо, чтобы диагностическое мероприятие было опаснее самого заболевания».
При назначении пневмоэнцефалографии должно приниматься во внимание и общесоматическое состояние больного опухолью мозга. Согласно мнению большинства авторов, разделяемому и нами, пневмоэнцефалография противопоказана при плохом общем состоянии больных, резких нарушениях сердечно-сосудистой деятельности на почве пороков сердца, при тяжелых формах артериосклероза и заболеваний почек, при церебральной форме гипертонической болезни, ангине, гриппе, карбункуле и т. п.
Многие больные во время производства пневмоэнцефалографии крайне волнуются. Это обстоятельство послужило поводом к применению перед пневмоэнцефалографией морфина и скополамина. Однако в последующем морфин был оставлен, так как он угнетает и без того (в связи с повышением внутричерепного давления) угнетенный дыхательный центр. В литературе неоднократно описывались ‘Случаи смерти больных, страдающих опухолями мозга, вслед за инъекцией морфина.
В настоящее время большинство невропатологов и нейрохирургов ограничивается применением люминала (0,1), даваемого накануне энцефалографии на ночь и 2-3 раза утром через часовые промежутки.
Какова диагностическая ценность пневмоэнцефалографии?
Грант (1932), применявший пневмоэнцефалографию по поводу опухолей мозга у 392 больных, указывает, что у 11,2% из них опухоль была диагностирована только благодаря применению этого метода; у 20,7% (от общего числа) были получены неубедительные результаты и у 6% диагноз был ошибочным. Совершенствование техники выполнения пневмоэнцефалографии и накопление опыта в чтении пневмоэнцефалограмм значительно улучшили ее результаты.
Так, при анализе результатов 758 пневмоэнцефалографий, сделанных в Институте нейрохирургии имени Н. Н. Бурденко (А. И. Арутюнов, 1940), были получены следующие данные: у 7% больных локализация опухоли была установлена только благодаря применению этого метода; у 24% -была уточнена локализация опухоли; у 47%; -подтвердился диагноз, поставленный при неврологическом обследовании; у 7 % - новых данных не получено; у 7,4%, - предполагалось наличие опухоли, но диагноз не подтвердился; у 5,5% -исследование не удалось или были получены неясные результаты; у 2,1%; - поставлен ошибочный диагноз.
На 221 пневмоэнцефалографию применяемых нами (за период с 1935 по 1948 г.) при верифицированных случаях опухоли мозга получены следующие результаты только с помощью пневмоэнцефалографии была диагностирована опухоль у 15,4% больных; уточнен диагноз, поставленный при неврологическом обследовании у 33,9%; подтверждена последняя у 49,4%; у 1,3% больных заключение при пневмоэнцефалографии оказалось ошибочным.
Таким образом, у половины больных с опухолями мозга с помощью пневмоэнцефалографии был или уточнен, или поставлен общий и топический диагноз опухоли головного мозга. Эти данные свидетельствуют об огромной помощи, которую этот метод исследования оказывает клиницисту. Особенно велика роль данных, доставляемых пневмоэнцефалографией, при супратенториальных опухолях. Однако немаловажно также и диагностическое значение вентрикулографии при субтенториальных опухолях. При этой локализации опухоли она лишь указывает на наличие препятствия для оттока спинномозговой жидкости в пределах задней черепной ямки, не разрешая в большинстве случаев вопроса о характере патологического процесса. Но уже одно то обстоятельство, что этот метод позволяет исключить супратенториальную локализацию патологического процесса, имеет для клинициста весьма важное значение.
Все раковые опухоли головного мозга делятся на три основных вида – внутримозговые, внемозговые и внутрижелудочковые новообразования. Выделяют также промежуточные и дополнительные виды заболевания, при этом симптомы могут говорить о наличии первичной или вторичной формы заболевания. Особого внимания в этом отношении заслуживают внутрижелудочковые опухоли головного мозга – вторичная внутримозговая онкология.
Внутрижелудочковые опухоли располагаются в желудочках головного мозга, а в систему желудочков входят боковые, 3-й и 4-й желудочки. Сложность лечения заболевания с очагом в данной области зависит от локализации опухоли, при этом новообразования, возникшие в полушарии головного мозг, и прорастающие в стенку желудочка не являются внитурижелудочковыми. Это вторичные опухоли желудочков, которые удалить полностью нет возможности, при этом опухоли боковых и 3-го желудочков, возникающие из хориоидного оплетения, эпендимы или субэпендимарного слоя, операбельны, и большая часть их не имеет злокачественности.
При возникновении новообразования в желудочке головного мозга нарушается свободная циркуляция ликвора – цереброспинальной жидкости желудочков. Понять это можно по первым симптомам заболевания, а чаще всего у больных появляются сильные головные боли, тошнота и рвота, что связано с излишним скоплением ликвора. В этом случае требуется операция на внутрижелудочковую проводимость. Ее успех зависит от локализации и размера опухоли.
В числе заболеваний, возникающих внутри желудочков, можно выделить эпендиму, растущую в полости желудочка, хориоидпапиллому, или доброкачественную опухоль, происходящую из эпителиальных клеток сосудистых сплетений. Также различают менингиому, возникающую в паутинной оболочке мозга, коллоидную кисту – доброкачественная опухоль, передаваемая, как правило, по наследству, краниофарингиому – еще одно врожденное заболевание, возникающее довольно редко.
Опухоль желудочка мозга доставляет немало хлопот больному, при этом не каждое новообразование можно успешно оперировать, хотя в НИИ им. Н. Бурденко не привыкли уступать заболеваниям, каким бы сложным они ни были. Большую сложность, в частности, может вызывать опухоль третьего желудочка головного мозга, что объясняется сложностью вскрытия 3-го желудочка с целью получения визуального обзора полости желудочка. Между тем, при удалении коллоидной кисты третьего желудочка таких сложностей не возникает, как правило.
Злокачественное новообразование желудочка мозга чаще всего имеет крупный размер и небольшую ножку, которая связывает опухоль с мозговой тканью, поэтому они, в большинстве своем, считаются операбельными. Большая часть из них, к тому же, не имеют злокачественности, однако подходить к лечению надо серьезно, а начинать его только после тщательно проведенной диагностики. На основании результатов МРТ, компьютерной томографии и других исследований, нейрохирурги НИИ им. Бурденко, проведут консультацию и примут решение относительно необходимости оперативного вмешательства или разработают другую схему лечения заболевания.
Введение
Опухоли области III желудочка являются глубинными новообразованиями и оказывают влияние на окружающие жизненно важные структуры головного мозга. Значительная сложность в хирургическом лечении опухолей III желудочка заключается в труднодоступности данной области головного мозга, глубине их расположения вблизи жизненно важных структур и тесной связи с важными подкорковыми структурами и стволовыми отделами головного мозга, многообразии топографо-анатомических вариантов, особенностях гистологии новообразований. Летальность при данной патологии достаточно высока и связана именно с этими факторами.
Данные новообразования являются редкими опухолями головного мозга и составляют 5–8% наблюдений, часто встречаются в молодом возрасте .
История опухолей III желудочка начинается с описания H. Wallmann в 1858 г. коллоидной кисты этой локализации . Начальный этап развития хирургии III желудочка сопровождает первые два десятилетия прошлого века, когда появился доклад о впервые примененной битемпоральной декомпрессии у больного с опухолью шишковидной железы (Cushing, 1904) .
Начало успешного хирургического лечения опухолей III желудочка связано с именем Dandy. Со времени первой успешной операции, произведенной Dandy в 1921 г. по поводу коллоидной кисты III желудочка, нейрохирургами разных стран накоплен значительный опыт хирургического лечения опухолей III желудочка .
A. Rhoton и соавторами внесен большой вклад в обоснование хирургических доступов к различным отделам III желудочка благодаря работам, посвященным топографии и микрохирургической анатомии артерий и вен головного мозга, детальной микрохирургической анатомии III желудочка .
Хирургический метод является основным в лечении опухолей области III желудочка, однако радикальное удаление опухоли весьма затруднительно в связи с ее глубинной локализацией в головном мозгу, степенью кровоснабжения опухоли и наличием общего кровоснабжения опухоли и разных отделов головного мозга, а также разнообразием гистологической структуры опухолей .
Гистоструктура новообразований данной области головного мозга представлена такими формами, как: краниофарингиома; астроцитома; коллоидная киста; глиома хиазмы с прорастанием в III желудочек; аденома гипофиза; киста кармана Ратке; опухоли из ткани шишковидной железы (пинеоцитомы, пинеобластомы, опухоль паренхимы шишковидной железы промежуточной дифференциации); парапинеальные опухоли (глиомы, ганглиоцитомы, менингиомы, липомы, эпидермоидные или дермоидные кисты); опухоли из эмбриональных клеток (герминомы, эмбриональные карциномы, хориокарциномы, тератомы, супраселлярные опухоли); глиальные кисты; плексуспапиллома .
Существенную роль в расширении возможностей современной нейрохирургии сыграло появление нейровизуализирующих методов диагностики: компьютерной томографии (КТ), магнитно-резонасной томографии (МРТ), ангиографии (исследование взаимоотношения сосудов головного мозга и опухоли, степени кровоснабжения). Оба диагностических метода - КТ и МРТ - информативны в определении локализации, характера процесса, степени выраженности гидроцефалии, однако МРТ головного мозга оказалась более информативной в определении размеров опухоли, характера ее роста и отношения к прилежащим структурам головного мозга .
Исходя из особенностей локализации опухолей и их взаимоотношения с окружающими жизненно важными структурами мозга, предопределяющих выбор наиболее оптимальных, максимально щадящих оперативных доступов, условно выделено три группы опухолей:
- опухоли области передних отделов III желудочка (занимающие его передний отдел и распространяющиеся до условной линии на уровне заднего края межжелудочковых отверстий);
- опухоли, полностью выполняющие III желудочек;
- опухоли области задних отделов III желудочка (распространяющиеся до заднего края межталамического сращения) .
Успех и результат оперативного вмешательства при опухолях области III желудочка в достаточно высокой степени зависят от правильного адекватного выбора хирургического доступа. Большое значение при выборе доступа имеют топографо-анатомические особенности опухоли, соотношение опухоли с прилежащими структурами головного мозга, степенью выраженности гидроцефалии. Требования к доступу - наличие наиболее близкого, безопасного и рационального подхода к опухоли III желудочка. Хирургические доступы к опухолями области III желудочка следующие: транскортикальный-трансвентрикулярный, субфронтальный, транскаллезный (задний и передний), птериональный, окципитальный транстенториальный, инфратенториальный супрацеребеллярный, транссфеноидальный .
Как отмечено выше, опухоли области III желудочка представлены разнообразными гистологическими формами: краниофарингиома; астроцитома; коллоидная киста; глиома хиазмы с прорастанием в III желудочек; аденома гипофиза; киста кармана Ратке; опухоли из ткани шишковидной железы (пинеоцитомы, пинеобластомы, опухоль паренхимы шишковидной железы промежуточной дифференциации); парапинеальные опухоли (глиомы, ганглиоцитомы, менингиомы, липомы, эпидермоидные или дермоидные кисты); опухоли из эмбриональных клеток (герминомы, эмбриональные карциномы, хориокарциномы, тератомы, супраселлярные опухоли); глиальные кисты; плексуспапиллома .
За последние десятилетия результаты хирургического лечения опухолей области III желудочка значительно улучшились благодаря использованию микрохирургической техники и возможностям нейроанестезиологии и интенсивной терапии . Но, несмотря на значительный успех, все же лечение, направленное на сохранение и улучшение качества жизни пациентов, остается и на сегодня достаточно сложным и неоднозначным.
Все это требует изучения разных подходов в терапии больных с новообразованиями данной области, позволяющих обеспечить оптимальное удаление опухоли и длительную выживаемость пациентов.
Метод лечения, хирургический доступ, объем удаления, гистоструктура опухоли могут влиять на выживаемость после хирургического лечения пациентов с опухолями области III желудочка.
Цель: изучить результаты лечения (выживаемость и летальность) больных с опухолями области III желудочка после нейрохирургических вмешательств для оптимизации лечения данной патологии, определить прогностический фактор.
Материалы и методы
В основу работы положены результаты анализа комплексного обследования и хирургического лечения 285 больных с опухолями области III желудочка, которые находились на обследовании и лечении в ГУ «Институт нейрохирургии им. акад. А.П. Ромоданова НАМН Украины» в период с 1993 по 2009 г. Среди них больных мужского пола - 148 (52%), женского -137 (48%). В зависимости от места исходного роста и локализации опухоли по отношению к стенкам III желудочка они были разделены на опухоли передних отделов - 79 (27,7%) наблюдений, выполняющих полость - 70 (24%) случаев и задних отделов III желудочка - 136 (48,3%) наблюдений. Больные обследованы с помощью клинических и инструментальных методов: КТ головного мозга до операции произведено у 234 пациентов, МРТ головного мозга до операции выполнено у 132 больных. Операция проведена в 285 случаях.
Проведена оценка доступа к опухолям области III желудочка, объема удаления опухоли в соответствии с гистологической формой. Для удаления опухолей области передних отделов и выполняющих полость III желудочка чаще применяли транскортикально-трансвентрикулярный доступ (49 и 86% наблюдений соответственно), для удаления опухолей области задних отделов III желудочка - в основном субокципитально-транстенториальный доступ (59% случаев). Тотально удалены: коллоидные кисты и плексуспапилломы в 100% случаев; краниофарингиомы - в 24% больных в области передних отделов III желудочка, а выполнявшие полость III желудочка - в 20% наблюдений; астроцитомы, выполнявшие полость, - в 25% случаев, в области задних отделов III желудочка - в 23%; опухоли паренхимы шишковидного тела - в 30%, герминативно-клеточные опухоли (ГКО) - в 38%. Субтотально удалены: краниофарингиомы, выполнявшие полость, - в 35% случаев, в передних отделах - в 24%; астроцитомы - в 18% в области передних отделов, у 30% пациентов - выполнявшие полость и 46% - в области задних отделов III желудочка; опухоли паренхимы шишковидного тела - в 40% наблюдений, ГКО - в 12% наблюдений. Частично удалены: краниофарингиомы передних отделов - в 32%, краниофарингиомы, выполнявшие полость, - в 40%; астроцитомы в передних отделах - в 76%, выполнявшие полость III желудочка - в 40%, в задних отделах - в 31% случаев; опухоли паренхимы шишковидного тела - в 30%, ГКО - у 50% пациентов.
Ликворошунтирующая операция(ЛШО)применена у больных с опухолями передних отделов III желудочка - в 8 случаях, с опухолями, выполняющими полость желудочка, - в 6, с опухолями задних отделов III желудочка - в 99.
Лучевая терапия применена у 138 (49%) пациентов, из них для опухолей области передних отделов III желудочка - у 24 (18%), выполняющих полость - у 22 (15%) пациентов, и для опухолей области задних отделов III желудочка - у 92 (67%) пациентов.
Катамнез исследован у 253 (89%) больных и варьировал от 2 до 171 мес (медиана составила 41 мес).
Летальность в ранний послеоперационный период составила 31 случай (17 - с опухолями, выполняющими полость III желудочка, по 7 - с опухолями передних и задних отделов), а в отдаленный период - 10 пациентов (опухоли задних отделов III желудочка - 6 случаев, передних отделов и выполняющих полость - по 2 наблюдения).
Общее состояние больных на момент первичного осмотра, при выписке и в отдаленный период оценивалось по шкале Карновского (в баллах) для взрослых и по шкале Lansky для детей.
Для выявления неблагоприятных факторов изучены: возраст, локализация опухоли в III желудочке, вид операции, степень радикальности удаления, гистоструктура опухоли. Факторы, оказывающие неблагоприятное влияние на исход, оценивали по шкале Карновского в пределах от 0 до 70 баллов. Значимость факторов определяли при помощи непараметрического метода χ 2 и соответствующего ему уровня статистической значимости (p) при сравнении двух выборок.
Исследования проводили для выборки пациентов, у которых благоприятность исхода оценивали в отдаленный период в двух временных диапазонах: от 2 до 5 лет (ранний отдаленный период) и от 6 до 10 лет (поздний отдаленный период) включительно.
Статистическую обработку проводили с использованием пакета программ «Statistica», версия 6,0. Высчитывание выживаемости произведено с помощью метода Kaplan - Meier .
Основные результаты и их обсуждение
Целью хирургического лечения больных с опухолями области III желудочка является сохранение жизни и улучшение качества жизни пациентов, снижение риска рецидивирования процесса. Основными критериями оценки эффективности хирургического лечения опухолей области III желудочка являются качество жизни, выживаемость и продолжительность жизни пациентов после операции.
Кривая выживаемости всей выборки больных с опухолями области III желудочка представлена на рис. 1

Рис. 1. Выживаемость после комбинированного лечения больных с опухолями области III желудочка
Как видно из рис. 1, для всех видов опухолей III желудочка в 85% наблюдений выживаемость после комбинированного лечения составила 7,5 года, а 10-летнюю выживаемость отмечали у 83% пациентов.
Сравнительная характеристика летальности в послеоперационный и отдаленный период в зависимости от локализации процесса в III желудочке представлена на диаграмме (рис. 2):

Рис. 2. Летальность после хирургического лечения больных с опухолями области III желудочка
В ранний послеоперационный период 17 больных умерли после удаления опухолей, выполняющих полость III желудочка. В отдаленный период из 10 летальных случаев большую часть констатировали после удаления опухолей задних отделов III желудочка (6 наблюдений).
Летальность больных в зависимости от радикальности удаления опухоли III желудочка представлена на диаграмме (рис. 3).

Рис. 3. Летальность больных в зависимости от радикальности удаления опухоли области III желудочка
Как видно (см. рис. 3), низкая летальность наблюдалась после тотального удаления опухоли.
При анализе катамнестических данных выявлено, что выживаемость пациентов после операции зависит от степени радикальности удаления, гистоструктуры опухоли III желудочка, применения лучевой терапии.
Кривая выживаемости пациентов с опухолями области III желудочка в зависимости от радикальности операции представлена на рис. 4.

Рис. 4. Выживаемость пациентов с опухолями области III желудочка в зависимости от радикальности удаления
Как видно из данных приведенных графиков, наибольшее количество пациентов с выживаемостью >10 лет выявлено в группе больных, у которых произведено тотальное удаление опухоли (83%), по сравнению с пациентами, у которых проведено субтотальное и частичное удаление опухоли, где 10-летняя выживаемость составила 74 и 77% соответственно (p=0,002). После применения ЛШО 5-летняя выживаемость составила 94%, а 7-летняя и выше - 87%. Такой высокий показатель выживаемости объясняется тем, что тяжесть состояния больных обусловлена окклюзионной гидроцефалией, которую устраняли применением вентрикулоперитонеостомии.
Гистоструктура опухоли также может влиять на выживаемость пациентов после операции.
Выживаемость пациентов в зависимости от гистоструктуры опухоли III желудочка представлена в графике (рис. 5):

Рис. 5. Выживаемость пациентов с опухолями области III желудочка в зависимости от гистоструктуры
Сравнивая кривые выживаемости согласно гистологии, следует заключить, что после удаления астроцитом, независимо от локализации, почти в 90% наблюдений выживаемость составила более 10 лет, что значительно выше (p=0,04) по сравнению с выживаемостью после удаления краниофарингиомы (до 2 лет - 72%, 5 лет и более - около 62%), опухолей паренхимы шишковидного тела (5 и более лет - 60%), ГКО (5-летняя выживаемость - 78%).
После тотального удаления коллоидных кист летальность отсутствовала.
Лучевая терапия применена у большей части пациентов в группе после удаления опухолей области задних отделов III желудочка (67%). Анализируя радикальность удаления опухоли и применение лучевой терапии, выявлено, что наибольшее количество пациентов облучены после частичного удаления опухолей передних отделов III желудочка (46%) и выполняющих полость III желудочка (45%), а также после ЛШО при опухолях области задних отделов III желудочка (75%). В зависимости от гистологической структуры облучению в большем количестве были подвержены пациенты с астроцитомами: 62% - из группы опухолей передних отделов III желудочка, 74% - с опухолями, выполняющими полость III желудочка, и 39% - в группе опухолей области задних отделов III желудочка.
Выживаемость пациентов после хирургического лечения и применения лучевой терапии представлена в графике (рис. 6).

Рис. 6. Выживаемость после применения лучевой терапии в послеоперационный период
7-летняя выживаемость составила практически 94%, а 10-летняя и более отмечена почти в 90% случаев. Летальность после хирургического лечения и применения лучевой терапии составила 6 больных: 2 пациента - после частичного удаления пинеаломы и герминомы, 1 пациент - после тотального удаления пинеаломы, 3 пациента - после ЛШО.
Кривая выживаемости после комбинированного лечения в зависимости от радикальности удаления опухоли и ее гистоструктуры представлена на рис. 7, 8.

Рис. 7. Выживаемость после применения лучевой терапии в зависимости от вида хирургического вмешательства

Рис. 8. Выживаемость после применения лучевой терапии в зависимости от гистологической структуры
Выживаемость пациентов до года после операции и облучения в зависимости от степени радикальности удаления составила 100% после тотального удаления, 98% - после ЛШО, 96% - после частичного удаления; 10-летняя выживаемость - 91% после частичного удаления, а 89% - после тотального удаления и ЛШО (p>0,05).
В зависимости от гистологии после комбинированного лечения 10-летняя выживаемость пациентов в большей степени (84% случаев) отмечена при опухолях паренхимы шишковидного тела при сравнении с лечением ГКО, при которых этот показатель составил 73% (p>0,05).
В исследовании опухолей области III желудочка и их комплексного лечения большое значение имеет изучение благоприятных и неблагоприятных факторов на исход заболевания.
Благоприятными прогностическими факторами в лечении больных с опухолями области III желудочка являются: качество жизни по шкале Карновского >70 баллов и тотальное удаление опухоли.
Неблагоприятными факторами, влияющими на результат хирургического лечения опухолей области III желудочка для отдаленного периода в ранних сроках (2–5 лет), являются:
- возрастной диапазон пациентов от 20 до 30 лет (р<0,01);
- ЛШО, которая не сопряжена с удалением опухоли (р<0,05).
В более поздних сроках (6–10 лет) отдаленного периода неблагоприятными факторами, оказывающими влияние на результат хирургического лечения после удаления опухолей III желудочка, названы:
- возраст пациентов;
- локализация опухоли;
- радикальность удаления опухоли;
- гистоструктура опухоли.
Наиболее неблагоприятное влияние на результат лечения в зависимости от возраста пациентов выявлено в диапазоне от 1 до 10 лет (р<0,05). В соответствии с локализацией опухоли неблагоприятный прогностический фактор определен в группе пациентов с опухолями, выполняющими полость III желудочка (р<0,01). При сравнении объема радикальности удаления опухолей III желудочка наиболее неблагоприятное влияние на результат лечения оказало частичное удаление опухоли (р<0,01). В зависимости от гистологической формы статистически достоверно установлено неблагоприятное влияние краниофарингиомы на исход заболевания (р<0,001).
Выводы
1. Выживаемость пациентов с опухолями области III желудочка зависит от локализации опухоли, радикальности удаления, применения лучевой терапии и гистоструктуры опухоли.
2. Наиболее высокая выживаемость пациентов (10-летняя) достигнута после тотального удаления опухолей области III желудочка (83%), при сравнении с субтотальным (74%) и частичным (77%) (p=0,002).
3. Выживаемость пациентов после удаления коллоидной кисты и астроцитомы выше по сравнению с выживаемостью после удаления краниофарингиомы, опухоли паренхимы шишковидного тела, ГКО: 100% выживаемость после тотального удаления коллоидной кисты и 10-летняя выживаемость после удаления астроцитомы (90%); 5-летняя выживаемость после удаления краниофарингиомы - 62%, опухоли паренхимы шишковидного тела - 60%, ГКО - 78% (p<0,05).
4. Благоприятными прогностическими факторами в лечении больных с опухолями области III желудочка являются: качество жизни по шкале Карновского >70 баллов и тотальное удаление опухоли. Неблагоприятными прогностическими факторами в отдаленный период являются: возраст пациентов от 1 до 10 лет (р<0,05), опухоли, выполняющие полость III желудочка (р<0,01), частичное удаление опухоли (р<0,01), а также краниофарингиома (р<0,001).
Список использованной литературы
1.
Вербова Л.Н. (1999) Диагностика и хирургическое лечение опухолей области III желудочка: Дис…. докт. мед. наук. НИИ нейрохирургии им. А.П. Ромоданова. Киев: 29–31, 136–140.
2. Гринберг Марк С. (2010) Нейрохирургия. МЕДпресс-информ, Москва: 474–497.
3. Дзейтова А.С. (2006) Опухоли паренхимы шишковидного тела: клиника, диагностика и лечение: Автореф. дис. … канд. мед. наук.: 14.00.28. НИИ нейрохирургии им. Н.Н. Бурденко. Москва: 21–23.
4. Коновалов А.Н., Горелышев С.К. (1988) Хирургические доступы к опухолям передних отделов III желудочка. Вопр. нейрохирургии, 2: 6–12.
5. Коновалов А.Н., Корниенко В.Н. (1985) Компьютерная диагностика в нейрохирургической клинике. Медицина, Москва: 296
6. Коновалов А.Н., Корниенко В.Н., Пронин И.Н. (1997) Магнитно-резонансная томография в нейрохирургии. Видар, Москва: 188–189, 241.
7. Коновалов А.Н., Пицхелаури Д.И. (2004) Лечение опухолей пинеальной области: монография. Москва: 17, 18, 65, 262–268, 271.
8. Легконогов В.А. (1973) Опухоли третьего желудочка мозга: монография. Москва: 3–18.
9. Реброва О.Ю. (2002) Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. МедиаСфера, Москва, 305 с.
10. Bosch D.A., Rahn T., Backland E.O. (1978) Treatment of Colloid Cysts of the Third Ventricle by Stereotactic Aspiration. Surg. Neurol., 9: 15–8.
11. Boström A., Boström J.P., von Lehe M. et al. (2011) Surgical treatment of choroid plexus tumors. Acta Neurochir., 153(2): 371–6.
12. Bruce J.N., Connoly E.S. (1995) Pineal cell and germ cell tumors. In: Brain tumors: 725–755.
13. Bruce J.N., Stein B.M. (1993) Supracerebellar approaches in the pineal region. In: Brain surgery: complication, avoidance and management. Ed. Apuzzo MlJ, New York, Churchil-Livingstone: 511–536.
14. Carmel P.W., Antunes J.L., Chang C.H. (1982) Craniopharyngiomas in children. Neurosurgery, 11: 382–389.
15. Chang T., Teng M.M., Guo W.-Y. et al. (1989) CT of pineal tumors and intracranial germ-cell tumors. AJNR, 153: 1039–44.
16. Cushing H. (1905) The establishment of cerebral hernia as a decompressive measure for a inaccessible brain tumors. Surg. Gynec. Obstet., 1: 297–314.
17. Easwer H.V., Bhattacharya R.N., Nair S. et al. (2008) Pre-coronal, paramedian minicraniotomy: a minimal access approach for microsurgical, transcallosal, transforaminal removal of colloid cysts of the third ventricle. Minim Invasive Neurosurg., 51(5): 253–7.
18. Fujii K., Lenkey C., Rhoton Al. (1980) Microsurgical Anatomy of the choroidal arteries: Lateral and third ventricle. J. Neurosurg., 52: 165–188.
19. Ganti S.R., Hilal S.K., Silver A.J. et al. (1986) CT of pineal region tumors. AJNR, 7: 97–104.
20. Kleihues P., Cavenee W. (2000) Tumors of Nervous System; Pathology and Genetics: World Health Organization International Classification Of tumors. IARC press, Lyon.
21. Little J.R., McCarty C.S. (1974) Colloid Cysts of the Third Ventricle. J. Neurosurg., 39: 230–5.
22. Manor R.S., Rar-Ziv J., Tadmor R. et al. (1990) Pineal germinoma with unilateral blindness. Seeding of germinoma cells with optic nerve sheath. J. Clinical Neuroi. and Ophthtalmol., 10: 239–243.
23. Nagata S., Rhoton A.L., Barry M. (1988) Microsurgical Anatomy of the Choroidal Fissure. Surg. Neurol., 30: 3–59.
24. Tonn J.–C., Westphal M., Rutka J.T., Grossman S.A. (2006) Neuro–Oncology of CNS Tumors. Springer, Berlin: 145–159, 207–217, 491–499, 505–517, 529–539.
25. Ono M., Rhoton A.L. (1984) Microsurgical Anatomy of the Deep venous System of the Brain. Neurosurgery, 15(5): 621–657.
26. Ono M., Rhoton Al. L., Barry M. (1980) Microsurgical anatomy of the region of the tentorial incisura. J. Neurosurg., 60: 365–399.
27. Rhoton A.L. (1987) Microsurgical Anatomy of the Third Ventricular Region. Surgery of the third ventricle/ M.L.J. Apuzzo (ed.). Baltimore: Williams, Wilkins: 92–167.
28. Rhoton A. L., Yamamoto I. (1981) Microsurgery of the third ventricle. Neurosurgery, 8, Part 1: 334–356.
29. Rhoton A. L., Yamamoto I., Peace D.A. (1981) Microsurgery of the third ventricle: Operative approaches. Neurosurgery, 8, Part 2: 357–373.
30. Saeki N., Rhoton Al. L. (1977) Microsurgical anatomy of the upper basilar artery and the posterior circle of Willis. J. Neurosurg., 46: 563–578.
Прогностичний фактор, летальність та виживаність хворих з пухлинами ділянки III шлуночка після комбінованого лікування
М.В. Базунов
ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України»
Резюме. Пухлини III шлуночка є глибинними новоутвореннями та істотно впливають на навколишні життєво важливі структури головного мозку. Широке застосування сучасних методів нейровізуалізації високого рівня дозволило збільшити можливості діагностики даних пухлин, а також виявляти топографо-анатомічні особливості та взаємозв’язок зі структурами головного мозку. При аналізі даних літератури, присвячених різним методам хірургічного та комбінованого лікування, виявлено неоднозначність думок щодо радикальності видалення, тактики ведення даної патології відповідно до гістоструктури та локалізації. Вивчення результатів хірургічного лікування необхідне для оптимізації лікування новоутворень III шлуночка, що нині є складним і актуальним. Вивчено результати хірургічного лікування (виживаність) у 285 хворих, які перебували на лікуванні в Інституті нейрохірургії ім. акад. А.П. Ромоданова НАМН України з1993 до 2009 р., з пухлинами ділянки III шлуночка.
Ключові слова: III шлуночок, пухлини, хірургічне лікування, виживаність, прогностичний фактор.
Prognostic factor, mortality and survival of patients with tumors of III ventricle after combined treatment
M.V. Bazunov
PI «Institute of neurosurgery named after acad. A.P. Romodanov NAMS of Ukraine»
Summary. Tumors of the third ventricle are deep-located tumors and significantly impact on the surrounding vital structures of the brain. The widespread use of modern neuroimaging techniques has increased ability to diagnose these tumors, and also allowed the identification of topographic and anatomical features and the relationship with the structures of the brain. The analysis of the literature on various methods of surgical and combined treatment revealed the ambiguity of views on the radical removal tactics of this pathology, respectively histostructure and localization. Research of results of surgical treatment is necessary to optimize the treatment of tumors of III ventricle, which is a complex and urgent today. We has been studied and evaluated the results of surgical treatment (survival) in 285 patients treated at the Institute of Neurosurgery named after acad. A.P. Romodanov NAMS of Ukraine from 1993 to 2009, with tumors of III ventricle.
Key words: III ventricle, tumors, surgical treatment, results of surgical treatment, survival, prognostic factor.
Новообразования головного мозга прочно занимают второе место среди онкологической патологии и причин смерти у детей с онкологическими заболеваниями, уступая по частоте только поражениям кроветворной и лимфатической систем. Опухоли III желудочка являются относительно редкой группой новообразований головного мозга. По данным ряда авторов, они составляют от 1,5% до 2 – 5%. Наиболее частыми новообразованиями III желудочка у детей являются субэпендимарные гигантоклеточные и пилоцитарные астроцитомы, нейрофибромы, герминомы, глиомы, краниофарингиомы, папилломы и пинеальные новообразования. У взрослых наиболее часты коллоидные кисты, метастазы, лимфомы, менингиомы, глиомы и пинеаломы. По данным разных авторов, в пинеальной области локализуются от 0,5 до 1% от всех верифицированных опухолей головного мозга. Частота возникновения опухолей пинеальной области у детей выше, чем у взрослых, и доходит до 2 – 6% от всех интракраниальных новообразований. Существует четкая региональная зависимость частоты обнаружения герминативно-клеточных опухолей. Так, в азиатских странах, а именно в Японии, отмечается самая высокая частота встречаемости этих опухолей, достигая 5 – 15% от всех выявляемых опухолей. Объяснения этому феномену до настоящего времени нет. Опухоли из пинеальной паренхимы составляют 17%, герминогенные опухоли диагностируются в 40 – 65% случаев и глиальные опухоли встречаются в 15% опухолей этой локализации. Паренхиматозные пинеальные опухоли чаще встречаются у детей первого десятилетия жизни, герминогенные опухоли чаще диагностируются у подростков, преимущественно мальчиков. Астроцитомы этой локализации имеют два возрастных пика: от 2 до 6 лет и с 12 до 18 лет.
Глиомы зрительных нервов и хиазмы составляют 3 – 5% от всех интракраниальных опухолей у детей. Более 75% опухолей, поражающих зрительные нервы, встречаются в течение первого десятилетия жизни с пиком в первые 5 лет и 90% возникают к возрасту 20 лет, поражения хиазмы более часто регистрируются у старших детей. Приблизительно 20% детей с глиомами хиазмы зрительных нервов страдают нейрофиброматозом I типа, и ряд исследователей утверждают, что прогноз у таких детей благоприятнее, чем у больных без нейрофиброматоза I типа. По другим данным, частота возникновения глиом хиазмы составляет 5 – 10%. Гистологически эти опухоли обычно низкозлокачественные фибриллярные или пилоцитарные астроцитомы. Их микроскопические признаки фактически идентичны таковым при классической мозжечковой астроцитоме и других срединных пилоцитарных опухолях. Признаки злокачественного роста встречаются редко. Среди всех первичных опухолей головного мозга у детей краниофарингиомы составляют 8,2% – 13% и являются самыми распространенными (40%) супратенториальными опухолями, и приблизительно 1/3 из них локализуются в III желудочке (интравентрикулярные и экстра-интравентрикулярные краниофарингиомы). По данным А.Ю Улитина (1997), в Санкт-Петербурге краниофарингиомы составили 1,8% от всех верифицированных опухолей головного мозга. Краниофарингиомы – наиболее частые опухоли супраселлярной области неглиального происхождения у детей и составляют 54% от всех опухолей супраселлярной области в детском возрасте и 20% – у взрослых. Наибольший пик заболеваемости – в возрасте 5 – 10 лет, у взрослых в 40 – 50 лет. Существенных половых различий не отмечается.
МОРФОЛОГИЯ ОПУХОЛЕЙ III ЖЕЛУДОЧКА
Морфология опухолей III желудочка различна. В передних отделах желудочка чаще наблюдаются коллоидные кисты, которые относятся к дизэмбриогенетическим новообразованиям. Ранее считалось, что они являются дериватами нейроэктодермы (парафиза – эмбриональной структуры, представляющей собой карман между конечным мозгом и передними отделами среднего мозга), однако больше данных, свидетельствующих об их энтодермальном происхождении. Они имеют эпителиальную выстилку и характерное слизистое содержимое и чаще встречаются у взрослых. Макроскопически коллоидные кисты представляют собой округлые или овальной формы образования, диаметр которых колеблется от 0,3 до 4 см. Киста имеет плотную капсулу с гладкой стенкой и вязкое содержимое зеленовато-серого цвета. В последнее время установлено их энтодермальное происхождение.
Эпендимомы возникают из внутренней выстилки желудочков мозга и составляют 5 – 10% всех опухолей ЦНС. Из них 2/3 возникают в задней черепной ямке, 10% – в спинномозговом канале и остальные – супратенториально в боковых и III желудочке. В пределах III желудочка эпендимарные опухоли преимущественно локализуются в его задних отделах, макроскопически имеют вид узла с преимущественной локализацией в полости желудочка. Хорошо отграничены от мозга, однако на отдельных участках они прорастают мозговое вещество. Глубина прорастания зависит от злокачественности. Эпендимомы имеют хорошо визуализируемые границы, в связи с чем возможно их тотальное удаление. Имплантационные метастазы злокачественных эпендимом редки. По данным R.I. Ernestus (1996), у детей частота эпендимом – 18,6%, менее чем астроцитом и медуллобластом (соотношение по полу 6:5 с преобладанием мужчин).
В пинеальной области встречаются: опухоли из зародышевых клеток – герминома, тератома (или эпидермоид, дермоид), тератома со злокачественной трансформацией, эмбриональная карцинома, эндодермальная синусовая опухоль, хориоидкарцинома и смешанные опухоли из зародышевых клеток; опухоли из пинеальной паренхимы – пинеалома, пинеоцитома, пинеобластома; глиомы и опухоли из velum interpositum – менингиомы, гемангиоперицитомы, ангиомы, кисты, реже – пинеоцитомы.
Пинеаломы и герминомы, по данным того же автора, могли находиться в супраселлярно-гипоталамической области и в других отделах. Пинеобластомы имеют инвазивный характер роста, часто метастазируют и по своему гистологическому строению и степени злокачественности близки к медуллобластомам. Пинеалоцитомы – хорошо отграниченные доброкачественные опухоли, часто имеют капсулу и кисты. Хориоидкарциномы и опухоли желточного мешка имеют вид больших инфильтрирующих образований, которые рано диссеминирют по спинномозговому каналу и в 10% случаев метастазируют за пределы ЦНС (в кости, легкие, лимфатические узлы).
Менингиома является весьма редким новообразованием этой области, особенно в детском возрасте. Их частота составляет 1,5 – 2,5%.
Краниофарингиомы, локализующиеся в этой области, часто кистозные, располагаются в полости III желудочка, проникают в боковые желудочки, экстравентрикулярно и нередко достигают гигантских размеров. В мировой литературе имеется одно сообщение о диагностике краниофарингиомы пинеальной области, случайно выявленное на аутопсии у женщины 58 лет, погибшей при пожаре, и второе наблюдение – в нашей клинике. Герминомы происходят из эмбриональных клеток, 20% из них располагаются в супраселлярной области, вовлекают дно и стенки III желудочка, могут первично исходить из базальных ганглиев. Герминомы могут метастазировать в стенки желудочков и базальные цистерны.
По гистологической структуре опухоли дна III желудочка почти все астроцитомы, чаще всего низкозлокачественные ювенильные пилоцитарные и иногда фибриллярные астроцитомы. Наши данные подтверждают это утверждение. Астроцитомы данной локализации – доброкачественные нейроэктодермальные опухоли, гистологическая структура которых не меняется в большинстве наблюдений на протяжении многих лет роста до и после оперативных вмешательств. Макроскопически астроцитомы в большинстве случаев плохо отграничены от окружающей ткани, гомогенные. Пилоцитарные астроцитомы имеют вид узла сероватого цвета. Границы опухоли достаточно четкие, довольно часто обнаруживаются кисты. В пилоцитарных астроцитомах много сосочков, иногда обнаруживаются опухоли с выраженным ангиоматозом.
Гамартомы гипоталамуса обоснованно относятся к порокам развития, располагаются между воронкой гипофиза и мамиллярными телами, гистологически состоят из ткани, сходной с гипоталамусом. Выделяют гормонально-активные и гормонально-неактивные формы.
Хориоидпапилломы составляют менее 1% (0,65% по нашим данным) всех интракраниальных опухолей и только менее 10% из них локализуются в III желудочке. Чаще всего эти опухоли возникают как функционирующие внутрижелудочковые папилломы крыши III желудочка, секретирующие спинномозговую жидкость. Опухоли сосудистых сплетений имеют довольно медленную скорость роста и достигают большого размера. Макроскопически имеют вид узла с мелкогранулярной дольчатой поверхностью (вид цветной капусты), темно-красного цвета, плотной консистенции, с преимущественной локализацией в просвете желудочка. Карцинома сосудистых сплетений – более агрессивная опухоль, составляющая 10 – 20% всех опухолей сосудистых сплетений. Справедливо считается, что хориоидкарциномы могут прорастать мозговое вещество на большом протяжении. Эта опухоль характеризуется чертами, свойственными анапластическим опухолям, и имеет склонность к диффузному экстракраниальному распространению. Хотя и папилломы сосудистых сплетений могут распространяться за пределы черепа, но их депозиты доброкачественного характера и, как правило, бессимптомны. Хориоидкарциномы имеют тенденцию к формированию имплантационных метастазов, которые обычно клинически проявляются на протяжении первых месяцев после операции.
В литературе имеются сообщения о 23 кавернозных мальформациях III желудочка.
В III желудочке могут встречаться также гемангиобластомы, метастатические медуллобластомы, глиобластомы, эпидермоидные кисты.
Классификация опухолей III желудочка
Общепринятым на данном этапе развития нейрохирургии является деление новообразований III желудочка на опухоли передних отделов, опухоли задних отделов (граница massa intermedia) и опухоли дна III желудочка.
Рис. Схематическое изображение локализации новообразований III желудочка.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ОПУХОЛЕЙ III ЖЕЛУДОЧКА
Клиническая диагностика опухолей III желудочка чрезвычайно трудна ввиду наличия в клинической картине заболевания весьма скудной очаговой симптоматики и развития почти одних лишь общемозговых симптомов (гидроцефально-гипертензионные явления, головные боли, застойные диски зрительных нервов).
В 1910 году появилась первая обобщенная работа по опухолям III желудочка, в которой Weisenburg анализирует 30 наблюдений (27 литературных и 3 собственных, из них 5 детей). И приходит к выводу, что для опухолей III желудочка нет специфических симптомов, а диагноз во всех случаях был установлен на аутопсии. Наиболее значимой работой по этой проблеме явилась вышедшая в 1933 г монография W. Dandy, в которой автор на основании 68 наблюдений (21 собственное и 47 литературных) анализирует клиническое течение и методики оперативного удаления опухолей III желудочка.
Всеми признано, что опухоли III желудочка долгое время протекают бессимптомно и только по мере роста и заполнения полости III желудочка, сдавления паравентрикулярных образований создают окклюзию ликворных путей и проявляются характерными клиническими симптомами. Хотя клиническая картина опухолей III желудочка зависит от локализации новообразования в пределах желудочка, ведущим в клинической картине заболевания является синдром внутричерепной гипертензии. И начало заболевания в большинстве случаев характеризуется появлением общемозговых симптомов (приступообразные головные боли, рвота, застойные явления на глазном дне), которые в большинстве случаев остаются ведущими в клинике заболевания.
Особенности клинического течения зависят от исходного пункта роста опухоли, ее направления, степени окклюзии ликворных путей и воздействия опухоли на образования III желудочка, а также на паравентрикулярные и стволовые отделы мозга. Краниобазальные симптомы поражения черепных нервов обусловлены гидроцефальным растяжением боковых и III желудочков с придавливанием черепно-мозговых нервов к костям основания черепа и крупным сосудам основания мозга. Хронический базальный арахноидит, нередко сопутствующий опухолям III желудочка, также иногда является причиной поражения отдельных черепно-мозговых нервов.
В известной степени клиническая картина опухолей III желудочка зависит от локализации опухоли в пределах желудочка, однако, можно отметить много общего для всей группы этих новообразований. Для них характерен синдром внутричерепной гипертензии. Начало заболевания при опухолях III желудочка во многом характеризуется появлением общемозговых симптомов (головные боли, рвота, застойные диски зрительных нервов), которые в большинстве случаев остаются ведущими в клинической картине заболевания. Менингеальные симптомы, обусловленные тоническими рефлексами, наблюдаются довольно часто. Характерным является диссоциация между постоянным и выраженным симптомом Кернига при слабой ригидности затылочных мышц. Некоторые авторы отмечают вынужденное положение головы или туловища, которые появляются в более поздние сроки заболевания, особенно во время приступов головных болей. Проявлений заболевания такого характера мы не встречали на нашем материале.
Характерным для опухолей задних отделов III желудочка является сочетание гипертензионного и четверохолмного синдромов. Первыми и ведущими симптомами у данной категории больных являются симптомы внутричерепной гипертензии с ранним развитием окклюзионной гидроцефалии. Патогномоничным для опухолей задних отделов III желудоча и пинеальной области является четверохолмный синдром, наблюдающийся в 50 – 87% случаев. Нередко при этих опухолях отмечается мозжечковая симптоматика, свидетельствующая о каудальном распространении опухоли. Встречаются также эндокринные расстройства, которые наиболее часто представлены синдромом преждевременного полового развития.
Клиника опухолей дна III желудочка складывается из эндокринных гипоталамических расстройств, поражения хиазмы, гипертензионного синдрома и поражения турецкого седла. Первыми признаками заболевания могут быть либо указанные симптомы изолированно, либо в сочетании, либо они могут варьировать в значительной степени. При краниофарингиомах III желудочка отмечается снижение остроты зрения, гипоталамо-гипофизарные расстройства, адипозогенитальный синдром, отставание в росте, несахарный диабет, нарушение сна и др. При глиомах зрительных путей на первый план выступают офтальмологические симптомы (снижение остроты зрения, нистагм, экзофтальм 43 – 88%), эндокринно-обменные нарушения (задержка роста, преждевременное половое развитие, несахарный диабет, 20 – 26%), гипертензионные головные боли (15 – 28%), еще реже – судорожный синдром, психические нарушения, парезы, (5 – 10%), а ассоциированность с нейрофиброматозом (13 – 29%). Гипталамические гамартомы, разделенные на два типа, по данным МРТ, (парагипоталамические и интрагипоталамические), характеризуются симптомами преждевременного полового развития при парагипоталамической и трудно поддающимися лечению припадками с задержкой умственного развития и поведенческими расстройствами при интрагипоталамической гамартоме.
Основными проявлениями заболевания при опухолях передних отделов III желудочка являются симптомы, характерные для окклюзии ликворных путей (симптомы внутричерепной гипертензии), в виде нарастающих по своей интенсивности головных болей, рвоты, застойных явлений на глазном дне, а у части больных – гипертензионные кризы, которые могут протекать крайне тяжело, и даже быть причиной смерти. Коллоидные кисты отличаются длительным течением заболевания и медленным увеличением их объема.
Все многообразие клинических симптомов при первичных опухолях III желудочка В.А. Легконогов (1973) свел к следующим синдромам: гидроцефально-гипертензионному, пароксизмальному, перивентрикулярному, мез- и ромбэнцефальным и синдрому психических нарушений.
Динамика развития клинических симптомов может указывать на исходное место роста опухоли. Если, например, заболевание начинается с появления четверохолмного синдрома, то можно предположить, что опухоль исходит из пинеальной области, если с офтальмологической симптоматики, то можно предположить, что местом исходного роста опухоли была сама хиазма. В случае, когда заболевание манифестирует диэнцефальными и эндокринно-обменными нарушениями, можно предположить, что опухоль первично возникла в дне III желудочка.
По мере роста опухоли, заполнения ею полости III желудочка в клинической картине заболевания могут обнаруживаться двигательные и чувствительные нарушения, мозжечковая и стволовая симптоматика. При опухолях III желудочка могут наблюдаться те или иные психические расстройства, связанные с повышением внутричерепного давления и локализацией опухоли. Хотя типичных эпилептических припадков при новообразованиях III желудочка не встречается. Изредка развиваются эпилептические припадки, которые чаще наблюдаются при новообразованиях, исходящих из дна III желудочка. Они проявляются потерей сознания или сопровождаются судорогами тонического характера (диэнцефальные припадки). W. Dandy (1933) называет эти припадки «интермиттирующими приступами». Характерными компонентами приступов были явления чувствтительного раздражения или вазомоторные нарушения (ознобоподобные дрожания в виде кратковременных пароксизмов, обильное потоотделение, повышение температуры тела до 38 – 39 0 градусов).
Длительность заболевания от появления первых симптомов до поступления в клинику колеблется от нескольких суток до 15 лет.
Y. Sawamura et. al. (1995) сообщает об асимптомных кистах пинеальной области у женщин с пиком в возрасте 21 г. – 30 лет размерами >5мм, случайно выявленных при МРТ головного мозга, а на аутопсии же частота таких кист доходила до 25 – 40%.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА ОПУХОЛЕЙ III ЖЕЛУДОЧКА
При диагностике опухолевого поражения необходимо, прежде всего, решить вопросы о локализации новообразования в пределах желудочка и преимущественном направлении роста опухоли, от чего непосредственно зависит выбор оптимального хирургического доступа и соответственно ближайшие результаты лечения.
Компьютерная и магнитно-резонансная томографии являются основными информативными методами исследования опухолей III желудочка, также как и других опухолей ЦНС. Предложенный в 70-х годах метод компьютерной томографии дает возможность с высокой точностью локализовать и устанавливать характер патологического процесса в мозге, выбрать адекватный метод их лечения.
КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ
Клиническое наблюдение 1. Больная К. 8 лет, поступила с жалобами на слепоту на правый глаз, выявленную случайно при осмотре в школе. На теле множественные коричневые пятна цвета «кофе с молоком» различной величины, на груди справа, на спине. Неврологически: двусторонняя пирамидная симптоматика. Vis: OD=светоощущение с носовой стороны; OS=1,0, почти полная височная гемианопсия. Расходящееся косоглазие. Слабость конвергенции. На глазном дне – однотонность диска правого зрительного нерва и резкое сужение артерий сетчатки обоих глаз.
На серии КТ головного мозга расширение, уплощение и деформация турецкого седла объемным гиподенсным образованием. Контуры его четкие, плотность однородная (+17 едН), без контрастного усиления. Размеры 3,0х2,5х2,2см. III желудочек компремирован, смещен кверху и влево.
На МРТ головного мозга – объемное образование 2,6х3,3х2,9см в ХСО с бугристыми контурами, неоднородной структуры. Компремирует дно III желудочка с его инфильтрацией. Хиазма не визуализируется. Латеральные отделы новообразования прилежат к кавернозным синусам и смещают в стороны сонные артерии. Локальный двусторонний отек в зоне подкорковых ядер. Супраселлярные цистерны деформированы и резко сужены.


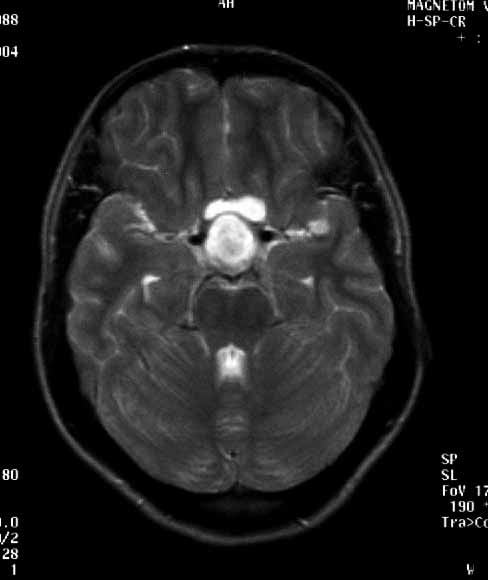
Рис. МРТ больной К. до операции.
Операция: правосторонняя краниотомия в лобной области, субтотальное удаление пилоцитарной астроцитомы хиазмы и правого зрительного нерва из субфронтального доступа.
Выписана без нарастания зрительных расстройств. Несколько расширилось поле зрения. Лучевая терапия в СОД 40Гр.
При обследовании через 3 г. данных за продолженный рост не получено (рис. 89).


Рис. МРТ той же больной в отдаленном периоде.
Клиническое наблюдение 2. Больной Ж. 12 лет, поступил с жалобами на периодические головные боли, диэнцефальные эпилептические припадки. Неврологически: очаговой симтоматики не выявлено. Vis: OD=1,0; OS=1,0. Поле зрения не изменено.
На серии КТ головного мозга расширение, уплощение и деформация турецкого седла объемным гиподенсным образованием. Контуры его четкие, плотность однородная (+19 едН), капсула накапливает контраст. Размеры 3,5х3,4х3,6см. создается впечатление, что III желудочек компремирован и смещен к верху.
На МРТ головного мозга определяется объемное образование 4,6х4,2х4,1см в области дна III желудочка с четкими контурами, неоднородной структуры с кистозными компонентами, компремирует и прорастает дно III желудочка. Капсула опухоли интенсивно накапливает контрастное вещество. Хиазма не визуализируется. Латеральные отделы новообразования прилежат к кавернозным синусам и обволакивают обе внутренние сонные артерии. Супраселлярные цистерны деформированы и резко сужены.

Рис. МРТ больного Ж. а – до операции, б – после операции.


Рис. МРТ больного Ж. в отдаленном периоде после операции.
Операция: правосторонняя кранитомия в лобной области, субтотальное удаление фибриллярной астроцитомы из субфронтального доступа.
Выписан без зрительных и эндокринных расстройств. Несколько расширилось поле зрения. Проведена химиотерапия нидраном в дозе 114 мг.
При наблюдении в течение 9 лет признаков продолженного роста опухоли не получено.
Клиническое наблюдение 3 . Больной С. 11 лет, поступил с жалобами на головные боли с рвотой, косоглазие и двоение по горизонтали. Длительность заболевания около 2 мес. Начало заболевания – головные боли с рвотой. Поступил в компенсированном состоянии. Состояние средней степени тяжести. Неврологически: нистагмоидные подергивания при крайних отведениях глазных яблок. Симптом Мажанди. Горизонтальный нистагм. Зрачки D>S, реакция на свет почти отсутствует. Сглажена левая носогубная складка. Симптом Мингацини. Глубокие рефлексы D>S, живые. Адиодохокинез слева. При пальце-пальцевой пробе левая рука отходит влево. На одной ноге не стоит. Симптом Кернига 145 0 . Ригидность затылочных мышц – на 1 поперечный палец. Голова наклонена влево. Vis: OD=0,8; OS=0,6, не корригируется. Резко выраженные застойные соски зрительных нервов обоих глаз. Поле зрения не изменено.

Рис. Предоперационные КТ головного мозга.
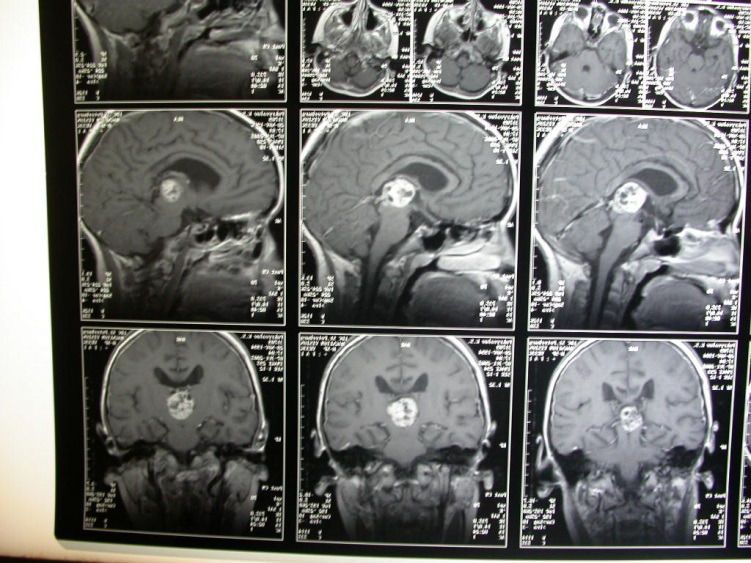



Рис. Предоперационные МРТ головного мозга.
На серии КТ головного мозга объемное образование задних отделов III желудочка, декомпенсированная окклюзионная тривентрикулярная гидроцефалия. Размеры 2,4х1,7х1,6см, содержит кальцификат. Задние отделы желудочка тампонированы опухолью. Боковые желудочки резко расширены. Резко выраженный перивентрикулярный отек.
На МРТ головного мозга – объемное образование задних отделов III желудочка 2,9х2,1х1,8см, неоднородной структуры, с четкими, ровными контурами, неравномерно, умеренно накапливающее контрастное вещество. Значительно расширены боковые желудочки
Операция: костно-пластическая трепанация задней черепной ямки, тотальное удаление тератомы из субтенториального супрацеребеллярного доступа.
Выписан в удовлетворительном состоянии, регрессировали застойные явления на глазном дне. Очаговых признаков поражения нервной системы, гипертензионной симптоматики при выписке не определялось.
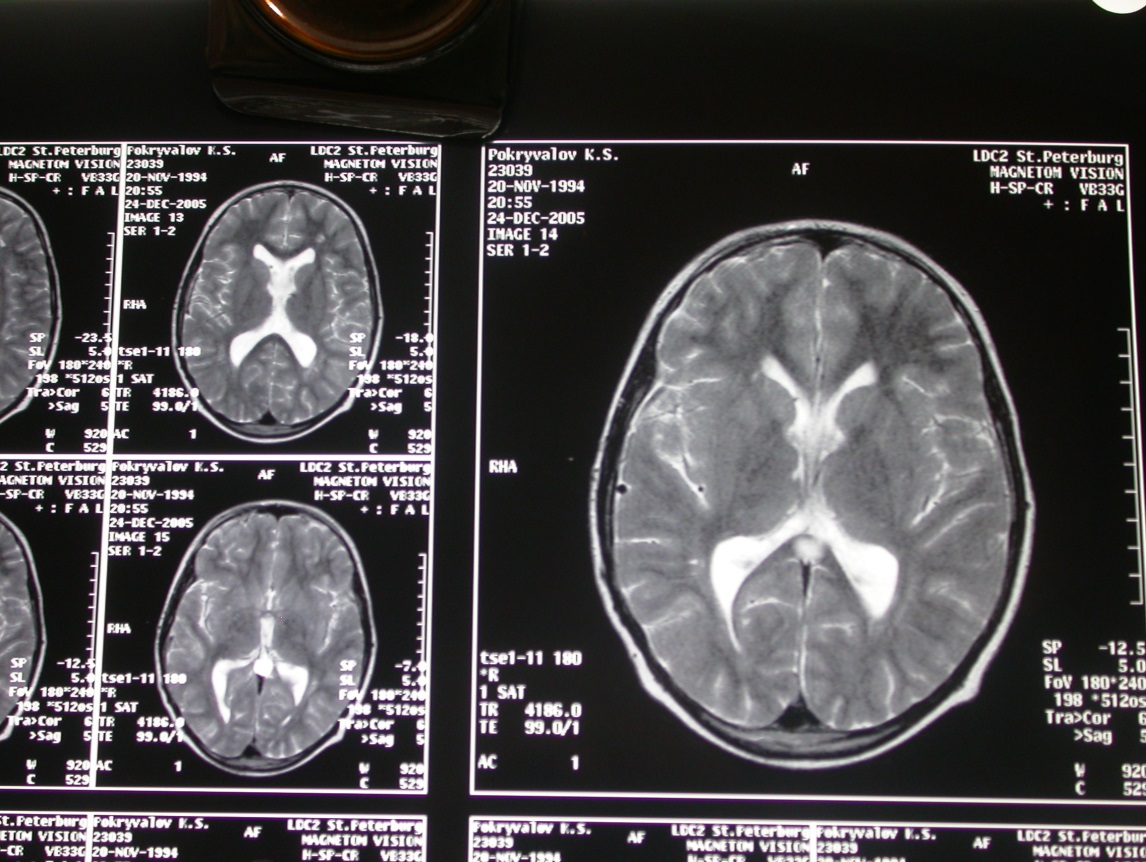



Рис. Послеопрационные МРТ головного мозга через 1г.
Гидроцефалия регрессировала. Опухолевая ткань не выявляется.
Клиническое наблюдение 4. Больной М. 7 лет, поступил с жалобами на головные боли с тошнотой и рвотой, повышенную утомляемость, сонливость, двоение перед глазами. Длительность заболевания 1 мес. Начало заболевания – головные боли, сопровождавшиеся рвотой. Течение заболевания прогредиентное. По месту жительства после выявления на КТ головного мозга объемного образования III желудочка с окклюзионной гидроцефалией выполнено вентрикулоперитонеальное шунтирование. При поступлении состояние тяжелое, установка головы влево. Неврологически: незначительный парез взора вверх, негрубое расходящееся косоглазие, снижены корнеальные рефлексы, симптом Бабинского слева. Интенция при выполнении пальце-носовой пробы. (Глазная щель D>S, расходящееся косоглазие, диплопия, четверохолмный синдром, легкое нарушение координации, синдром Гертвига – Мажанди). Vis: OD=0,7; OS=0,7 cyl – 0,25 = 0,8-0,9. На глазном дне – осложненные застойные соски зрительных нервов. Поле зрения не изменено.
На серии КТ головного мозга – объемное образование задних отделов III желудочка, неоднородной структуры, размерами 3,2х2,8х2,9см. Боковые желудочки и передние отделы III резко расширены (дисфункция шунтирующей системы). Тень шунта в заднем роге правого бокового желудочка.
На МРТ – в проекции шишковидной железы определяется объемное образование неоднородной структуры с нечеткими границами, расположенное центрально и больше слева, интенсивно накапливающее контрастное вещество. Размеры 33х29х30мм. Полость III желудочка резко деформирована. Шунт в желудочке справа.


Рис. Дооперационные МРТ больного.
Операция: костно-пластическая трепанация в правой затылочной области с заходом за среднюю линию, тотальное удаление эпидермоида в сочетании с кавернозной ангиомой задних отделов III желудочка из субокципитального доступа с рассечением мозолистого тела в задней части.


Рис. Послеоперацинные МРТ больного.
Выписан в удовлетворительном состоянии, регрессировали застойные явления. При повторной госпитализации 28.10.1994 г. после предварительной пробы шунтирующая система удалена. Катамнез 8 лет, без очаговой симптоматики.
Клиническое наблюдение 5. Больной Б. 8 лет, поступил с жалобами на головные боли с рвотой, двоение перед глазами. Длительность заболевания около 1 мес. Начало заболевания с головных болей и рвоты. Поступил в тяжелом, компенсированном по витальным функциям состоянии переводом. По месту жительства выполнено вентрикулоперитонеальное шунтирование по поводу окклюзионной гидроцефалии, вызванной объемным образованием задних отделов III желудочка. Неврологически: сознание на уровне оглушения. Четверохомный синдром. Реакция на свет почти отсутствует. Положительный симптом Кернига (155 0). Двусторонний симптом Бабинского. Спонтанный нистагм. Vis: OD=0,3; OS=0,2, не корригируется. Постзастойные соски зрительных нервов обоих глаз. Синдром Парино. Поле зрения не изменено.
На серии КТ головного мозга – объемное образование задних отделов III желудочка. Размеры 3,1х3,5х3,2см, содержит кальцификат и кистозный компонент. Задние отделы желудочка тампонированы опухолью. Состояние после вентрикулоперитонеального шунтирования. Тень шунтирующей системы в переднем роге левого бокового желудочка. Субарахноидальные пространства расширены. Боковые желудочки не расширены.
На МРТ головного мозга объемное образование задних отделов III желудочка 3,8х4,1х3,2см, неоднородной структуры, с нечеткими, относительно ровными контурами и кистозным компонентом. Интенсивно и неравномерно накапливает контрастное вещество. Желудочковая система не расширена.

Рис. Дооперационные КТ головного мозга.

Рис. Дооперационные МРТ головного мозга.
Операция: 05.06.1997 г. костно-пластическая трепанация задней черепной ямки, тотальное удаление пинеоцитомы из субтенториального супрацеребеллярного доступа.
Выписан в удовлетворительном состоянии, регрессировали застойные явления на глазном дне, без очаговой симптоматики. Катамнез 5 лет, без признаков рецидива.

Рис. Послеоперационные МРТ того же больного.
Опухолевой ткани в зоне оперативного вмешательства не выявлено
Резюме
Опухоли III желудочка являются глубинными новообразованиями и существенно воздействуют на окружающие жизненно важные структуры головного мозга. Широкое применение современных методов нейровизуализации высокого уровня позволило увеличить возможности диагностики данных опухолей, а также выявлять топографо-анатомические особенности и взаимосвязь со структурами головного мозга. При анализе данных литературы, посвященных различным методам хирургического и комбинированного лечения, выявлена неоднозначность мнений в отношении радикальности удаления, тактики ведения данной патологии соответственно гистоструктуре и локализации. Изучение результатов хирургического лечения необходимо для оптимизации лечения новообразований III желудочка, что является сложным и актуальным на сегодняшний день.
Изучены результаты хирургического лечения (выживаемость) у 292 больных, находившихся на лечении в Институте нейрохирургии им. акад. А.П. Ромоданова АМН Украины с1993 по 2009 г., с опухолями области III желудочка.
Пухлини III шлуночка є глибинними новоутвореннями та істотно впливають на навколишні життєво важливі структури головного мозку. Широке застосування сучасних методів ней-ровізуалізації високого рівня дозволило збільшити можливості діагностики даних пухлин, а також виявляти топографо-анатомічні особливості та взаємозв’язок зі структурами головного мозку. При аналізі даних літератури, присвячених різним методам хірургічного та комбінованого лікування, виявлена неоднозначність думок щодо радикальності видалення, тактики ведення даної патології відповідно до гістоструктури та локалізації. Вивчення результатів хірургічного лікування необхідно для оптимізації лікування новоутворень III шлуночка, що є складним і актуальним на сьогоднішній день.
Вивчено результати хірургічного лікування (виживаність) у 292 хворих, які перебували на лікуванні в Інституті нейрохірургії ім. акад. А.П. Ромоданова АМН України з1993 по 2009 р., з пухлинами області III шлуночка.
Third ventricular tumors are deep-located neoplasms, which significantly impact on surrounding vital structures of the brain. The widespread use of modern neuroimaging techniques has increased ability to diagnose these tumors, and also to identify topographic and anatomical features and correlation with brain structures. The analysis of the literature on various methods of surgical and combined treatment revealed the ambiguity of views on the radical removal tactics of this pathology, respectively histostructure and localization. Study of outcomes of surgical treatment is necessary to optimize the treatment of third ventricular tumors, which is difficult and urgent today.
We have studied treatment outcomes (survival rate) in 292 patients with third ventricular tumors. They had been treated in Institute of neurosurgery named after acad. A.P. Romodanov of Academy of medical sciences of Ukraine in 1993–2009.
Ключевые слова
опухоли, III желудочек, хирургическое лечение, выживаемость.
пухлини, III шлуночок, хірургічне лікування, виживаність.
tumors, third ventricle, surgical treatment, survival rate.
Введение
Новообразования III желудочка являются достаточно редкими среди опухолей головного мозга (5-8 %), преимущественно встречаются в молодом возрасте и очень разнообразны по гистоструктуре .
История опухолей III желудочка начинается с описания Wallmann в 1858 г. коллоидной кисты этой локализации . Начальный этап развития хирургии III желудочка приходится на первые два десятилетия прошлого века, когда появился доклад о впервые примененной битемпоральной декомпрессии у больного с опухолью шишковидной железы (Cushing, 1904) .
Начало успешного хирургического лечения опухолей III желудочка связано с именем Dandy. Со времени первой успешной операции, произведенной Dandy в 1921 году по поводу коллоидной кисты III желудочка, нейрохирургами разных стран накоплен значительный опыт хирургического лечения опухолей III желудочка .
A. Rhoton и соавторами внесен большой вклад в обоснование хирургических доступов к различным отделам III желудочка благодаря работам, посвященным топографии и микрохирургической анатомии артерий и вен головного мозга, детальной микрохирургической анатомии III желудочка .
Существенную роль в расширении возможностей современной нейрохирургии сыграло появление нейровизуализирующих методов диагностики: компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), ангиографии (исследование взаимоотношения сосудов головного мозга и опухоли, степени крово-снабжения). Оба диагностических метода — КТ и МРТ информативны в определении локализации, характера процесса, степени выраженности гидроцефалии, однако МРТ головного мозга оказалась более информативной в определении размеров опухоли, характера ее роста и отношения к прилежащим структурам головного мозга .
Как указывалось выше, опухоли области III желудочка представлены разнообразной гистологией: краниофарингиома; астроцитома; коллоидная киста; глиома хиазмы с прорастанием в III желудочек; аденома гипофиза; киста кармана Ратке; опухоли из ткани шишковидной железы (пинеоцитомы, пинеобластомы, опухоль паренхимы шишковидной железы промежуточной дифференцировки); парапинеальные опухоли (глиомы, ганглиоцитомы, менингиомы, липомы, эпидермоидные или дермоидные кисты); опухоли из эмбриональных клеток (герминомы, эмбриональные карциномы, хориокарциномы, тератомы, супраселлярные опухоли); глиальные кисты; плексус-папиллома .
За последние десятилетия результаты хирургического лечения опухолей III желудочка значительно улучшились благодаря использованию микрохирургической техники и возможностям нейроанестезиологии и интенсивной терапии . Но, несмотря на значительный успех, лечение, направленное на сохранение и улучшение качества жизни пациентов, остается и на сегодняшний день достаточно сложным и неоднозначным.
Все это требует изучения разных подходов в лечении новообразований данной области, позволяющих обеспечить оптимальное удаление опухоли и добиться высоких показателей качества жизни.
Метод лечения, хирургический доступ, объем удаления, гистоструктура опухоли могут влиять на выживаемость и качество жизни пациентов с опухолями III желудочка после хирургического лечения.
Цель: изучить выживаемость больных с опухолями области III желудочка после нейрохирургических вмешательств, установить прогностический фактор для оптимизации хирургического лечения данной патологии.
Материалы и методы
В основу работы положены результаты анализа комплексного обследования и хирургического лечения 292 больных с опухолями области III желудочка, которые находились на обследовании и лечении в ГУ «Институт нейрохирургии имени академика А.П. Ромоданова АМН Украины» в период с 1993 по 2009 г. Среди них больных мужского пола — 152 (52 %), женского пола — 140 (48 %). В зависимости от места исходного роста и локализации опухолей по отношению к стенкам III желудочка они были разделены на опухоли передних отделов — 81 наблюдение (27,7 %), выполняющие полость — 70 наблюдений (24 %) и задних отделов III желудочка — 141 наблюдение (48,3 %). Больные обследованы клинически и инструментально: КТ головного мозга до операции произведена у 234 пациентов, МРТ головного мозга до операции выполнена у 132 больных. Операция проведена в 285 случаях (97,6 %). Не оперированы 2 больных с опухолями передних отделов и 5 больных с опухолями задних отделов III желудочка.
Проведена оценка объема удаления опухоли в соответствии с гистологической формой. Тотально удалены: коллоидные кисты и плексус-папилломы в 100 % наблюдений; краниофарингиомы — в 24 % наблюдений в области передних отделов III желудочка, а выполнявшие полость III желудочка — в 20 % наблюдений; астроцитомы, выполнявшие полость, — в 25 % наблюдений, в области задних отделов III желудочка — в 23 % наблюдений; опухоли паренхимы шишковидного тела — в 30 % наблюдений, герминативноклеточные опухоли — в 38 % наблюдений. Субтотально удалены: краниофарингиомы, выполнявшие полость, — в 35 % наблюдений, в передних отделах — 24 % наблюдений; астроцитомы — в 18 % наблюдений в области передних отделов, в 30 % наблюдений — выполнявшие полость и в 46 % наблюдений — в области задних отделов III желудочка; опухоли паренхимы шишковидного тела — в 40 % наблюдений, герминативноклеточные опухоли — в 12 % наблюдений. Частично были удалены: краниофарингиомы передних отделов — в 32 % наблюдений, краниофарингиомы, выполнявшие полость, — в 40 % наблюдений; астроцитомы в передних отделах — 76 % наблюдений, выполнявшие полость III желудочка — 40 % наблюдений, в задних отделах — 31 % наблюдений; опухоли паренхимы шишковидного тела — в 30 % наблюдений, герминативноклеточные опухоли — в 50 % наблюдений.
Ликворошунтирующая операция применена у больных с опухолями передних отделов III желудочка — 8 наблюдений, с опухолями, выполняющими полость желудочка, — 6 наблюдений, с опухолями задних отделов III желудочка — 99 наблюдений.
Катамнез исследован у 260 больных (89 % наблюдений) и варьировал от 3 месяцев до 353 месяцев (медиана составила 42 месяца).
Летальность в раннем послеоперационном периоде составила 31 наблюдение (17 наблюдений с опухолями, выполняющими полость III желудочка, по 7 наблюдений с опухолями передних и задних отделов), а в отдаленном периоде — 10 наблюдений (опухоли задних отделов III желудочка — 6 наблюдений, передних отделов и выполняющих полость — по 2 наблюдения).
Изучены факторы, оказывающие неблагоприятное влияние на исход, который оценивался по шкале Карновского (в пределах от 0 до 70 баллов). Значимость факторов определялась при помощи непараметрического метода c 2 и соответствующего ему уровня статистической значимости (p) при сравнении двух выборок. Исследования проводились для выборки пациентов, у которых благоприятность исхода оценивалась в отдаленном периоде в двух временных диапазонах: от 2 до 5 лет (ранний отдаленный период) и от 6 до 10 лет (поздний отдаленный период) включительно.
Статистическая обработка проводилась с использованием пакета программ Statistica, версия 6.0. Высчитывание выживаемости произведено с помощью метода Kaplan — Meier .
Результаты и их обсуждение
Основным критерием оценки эффективности хирургического лечения опухолей области III желудочка является выживаемость и продолжительность жизни пациентов после операции.
Кривая выживаемости всей выборки больных с опухолями области III желудочка представлена на рис. 1.
Как показано на рис. 1, для всех видов опухолей III желудочка в 85 % наблюдений выживаемость после операции составила 7,5 года, а 10-летняя выжива-емость наблюдалась у 83 % пациентов. Таким образом, оценивая выживаемость всей выборки пациентов с опухолями области III желудочка, можно заключить, что если пациент прожил после операции 5 лет, то вероятность выживания более 10 лет достаточно высока (больше 90 %).
При анализе катамнестических данных выявлена зависимость послеоперационной выживаемости от локализации опухоли в III желудочке, степени радикальности удаления и гистоструктуры новообразования.
Кривая выживаемости пациентов после хирургического лечения опухолей III желудочка в зависимости от локализации отображена на рис. 2.
Медиана катамнеза для пациентов с опухолями передних отделов составила 39 месяцев (варьировал от 3 до 158 мес.), для выполняющих полость — 42 месяца (от 3 до 353 мес.) и для задних отделов — 44 месяца (от 3 до 171 мес.).
Из представленного на рис. 2 графика видно, что в группе опухолей задних отделов III желудочка выживаемость до 7,5 года составила около 91 % наблюдений, а 10-летняя — 87 % наблюдений. В группе опухолей передних отделов III желудочка выживаемость до 2 лет составила около 84 % наблюдений, а 10-летняя выживаемость — 79 % наблюдений. Для пациентов после удаления опухолей, выполняющих полость желудочка, 10-летняя и более выживаемость составила 77,5 % наблюдений.
Одним из существенных факторов, влияющих на выживаемость пациентов после операции, является степень радикальности удаления опухоли. Тотальное удаление опухоли III желудочка произведено в 60 наблюдениях, субтотальное — у 39 пациентов и частичное удаление произведено в 59 наблюдениях.
Кривая выживаемости пациентов с опухолями области III желудочка в зависимости от радикальности операции представлена на рис. 3.
Как видно из приведенных на рис. 3 графиков, наибольшее количество пациентов с выживаемостью более 10 лет выявлено в группе больных, у которых произведено тотальное удаление опухоли (83 % наблюдений), по сравнению с пациентами, которым произведено субтотальное и частичное удаление опухоли, среди которых десятилетняя выживаемость составила 74 и 77 % наблюдений соответственно (p = 0,002).
После применения ликворошунтирующей операции 5-летняя выживаемость составила 94 % наблюдений, а 7-летняя и более выживаемость — 87 %. Такой высокий показатель выживаемости объясняется тем, что тяжесть состояния больных была обусловлена окклюзионной гидроцефалией, которая устранялась после применения вентрикулоперитонеостомии.
Гистоструктура опухоли также может влиять на качество жизни и на выживаемость пациентов после операции.
Выживаемость пациентов в зависимости от гистоструктуры опухоли III желудочка представлена на рис. 4.
/185/185.jpg)
Сравнивая кривые выживаемости согласно гистологии, следует заключить, что после удаления астроцитом, независимо от локализации, почти в 90 % наблюдений выживаемость составила более 10 лет, что значительно больше (p = 0,04) по сравнению с выживаемостью после удаления краниофарингиомы (до 2 лет — 72 % наблюдений, 5 лет и более — около 62 % наблюдений), опухолей паренхимы шишковидного тела (5 и более лет — в 60 % наблюдений), герминативноклеточные опухоли (5-летняя выживаемость — 78 % наблюдений).
После тотального удаления коллоидных кист летальность отсутствовала.
Лечение злокачественных форм опухолей преду-сматривает хирургическое удаление с последующим применением лучевой терапии, химиотерапии.
Выживаемость пациентов после хирургического лечения и применения лучевой терапии представлена на рис. 5.
Семилетняя выживаемость составила практически 94 % наблюдений, а 10-летняя и более выживаемость прослежена почти в 90 % наблюдений.
Летальность после хирургического лечения и применения лучевой терапии составила 7 наблюдений: 2 пациента — после частичного удаления пинеаломы и герминомы, 1 пациент после тотального удаления пинеаломы, 3 пациента — после ликворошунтирующей операции и 1 пациент без операции.
Результаты статистической обработки данных исследования позволили выделить ряд благоприятных и неблагоприятных факторов, влияющих на исход заболевания.
Неблагоприятными факторами, влияющими на результат хирургического лечения опухолей области III желудочка, для отдаленного периода в ранних сроках (2-5 лет) являются:
— возрастной диапазон пациентов от 20 до 30 лет (р < 0,01);
— ликворошунтирующая операция, которая не сопряжена с удалением опухоли (р < 0,05);
— отсутствие данных гистологического исследования после ликворошунтирующей операции (р < 0,05).
В более поздних сроках (6-10 лет) отдаленного периода в качестве неблагоприятных факторов, оказывающих влияние на результат хирургического лечения после удаления опухолей III желудочка, определены:
— возраст пациентов;
— локализация опухоли;
— радикальность удаления опухоли;
— гистоструктура опухоли.
Наиболее неблагоприятное влияние на результат лечения в зависимости от возраста пациентов выявлено в диапазоне от 1 до 10 лет (р < 0,05).
В зависимости от локализации опухоли неблагоприятный прогностический фактор определен в группе пациентов с опухолями, выполняющими полость III желудочка (р < 0,01).
При сравнении объема радикальности удаления опухолей III желудочка наиболее неблагоприятное влияние на результат лечения оказало частичное удаление опухоли (р < 0,01).
В зависимости от гистологической формы статистически достоверно установлено неблагоприятное влияние краниофарингиомы на исход заболевания (р < 0,001).
Выводы
1. Выживаемость пациентов с опухолями области III желудочка после нейрохирургического лечения зависит от локализации опухоли, радикальности удаления и гистоструктуры опухоли.
2. Наиболее высокая выживаемость пациентов (10-летняя) достигнута после тотального удаления опухолей области III желудочка (83 % наблюдений) при сравнении с субтотальным (74 % наблюдений) и частичным (77 % наблюдений) удалением (p = 0,002). В зависимости от гистоструктуры выживаемость больных в 100 % наблюдений установлена после тотального удаления коллоидной кисты, наиболее высокая выживаемость (90 % наблюдений) — после удаления астроцитомы (10 лет) при сравнении с удалением краниофарингиомы (5 лет — 62 % наблюдений), опухолей паренхимы шишковидного тела (5 лет — 60 % наблюдений) и герминативноклеточных опухолей (5 лет — 78 % наблюдений), при p < 0,05.
3. Хирургическое лечение больных с опухолями области III желудочка повышает выживаемость в отдаленном периоде. Преодоление 5-летнего порога выживаемости после тотального удаления опухоли значительно повышает вероятность длительного выживания пациентов с указанной патологией (p = 0,004).
4. В результате статистической обработки определены неблагоприятные прогностические факторы в отдаленном периоде: возраст пациента от 1 до 10 лет (р < 0,05), локализация — опухоль, выполняющая полость III желудочка (р < 0,01), объем удаления — частичная степень удаления опухоли (р < 0,01), гистология — у краниофарингиомы наиболее прогностически неблагоприятная значимость для выживания (р < 0,001).
Список литературы
1. Вербова Л.Н. Диагностика и хирургическое лечение опухолей области III желудочка: Дис… д-ра мед. наук / НИИ нейрохирургии им. А.П. Ромоданова. — К., 1999. — С. 29-31, 136-140.
2. Гринберг Марк С. Нейрохирургия. — М.: МЕДпресс-информ, 2010. — С. 474-497.
3. Дзейтова А.С. Опухоли паренхимы шишковидного тела: клиника, диагностика и лечение: Автореф. дис… канд. мед. наук: 14.00.28 / НИИ нейрохирургии им. Н.Н. Бурденко. — М., 2006. — С. 21-23.
4. Коновалов А.Н., Горелышев С.К. Хирургические доступы к опухолям передних отделов III желудочка // Вопр. нейрохирургии. — 1988. — № 2. — С. 6-12.
5. Коновалов А.Н., Корниенко В.Н. Компьютерная диагностика в нейрохирургической клинике. — М.: Медицина, 1985. — С. 296.
6. Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии. — М.: Видар, 1997. — С. 188-189, 241.
7. Коновалов А.Н., Пицхелаури Д.И. Лечение опухолей пинеальной области. — М., 2004. — С. 17, 18, 65, 262-268, 271.
8. Легконогов В.А. Опухоли третьего желудочка мозга. — М., 1973. — С. 3-18.
9. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. — М.: МедиаСфера, 2002. — 305 с.
10. Bosch D.A., Rahn T., Backland E.O. Treatment of Colloid Cysts of the Third Ventricle by Stereotactic Aspiration // Surg. Neurol. — 1978. — V. 9. — Р. 15-8.
11. Boström A., Boström J.P., von Lehe M. et al. Surgical treatment of choroid plexus tumors.
12. Bruce J.N., Connoly E.S. Pineal cell and germ cell tumors // Brain tumors. — 1995. — Р. 725-755.
13. Bruce J.N., Stein B.M. Supracerebellar approaches in the pineal region // Brain surgery: complication, avoidance and management / Ed. by M.J. Apuzzo. — New York, Churchil-Livingstone, 1993. — Р. 511-536.
14. Carmel P.W., Antunes J.L., Chang C.H. Craniopharyngiomas in children // Neurosurgery. — 1982. — V. 11. — P. 382-389.
15. Chang T., Teng M.M., Guo W.-Y et al. CT of pineal tumors and intracranial germ-cell tumors // AJNR. — 1989. — V. 153. — P. 1039-1044.
16. Cushing H. The establishment of cerebral hernia as a decompressive measure for a inaccessible brain tumors // Surg. Gynec. Obstet. — 1905. — Vol. 1. — P. 297-314.
17. Easwer H.V., Bhattacharya R.N., Nair S. et al. Pre-coronal, paramedian minicraniotomy: a minimal access approach for microsurgical, transcallosal, transforaminal removal of colloid cysts of the third ventricle // Minim. Invasive Neurosurg. — 2008. — V. 51(5). — Р. 253-7.
18. Fujii K., Lenkey C., Rhoton Al. Microsurgical Anatomy of the choroidal arteries: Lateral and third ventricle // J. Neurosurg. — 1980. — V. 52. — P. 165-188.
19. Ganti S.R., Hilal S.K., Silver A.J. et al. CT of pineal region tumors // AJNR. — 1986. — V. 7. — P. 97-104.
20. Kleihues P., Cavenee W. Tumors of Nervous System; Pathology and Genetics: World Health Organization International Classification Of tumors. — Lyon, IARC press, 2000.
21. Little J.R., McCarty C.S. Colloid Cysts of the Third Ventricle // J. Neurosurg. — 1974. — V. 39. — Р. 230-5.
22. Manor R.S., Rar-Ziv J., Tadmor R. еt al. Pineal germinoma with unilateral blindness. Seeding of germinoma cells with optic nerve sheath // J. of Clinical Neurol. and Ophthtalmol. — 1990. — V. 10. P. 239-243.
23. Nagata Shinji, Rhoton Al.L., Barry M. Microsurgical Anatomy of the Choroidal Fissure // Surg. Neurol. — 1988. — V. 30. — P. 3-59.
24. Neuro-Oncology of CNS Tumors / J.-C. Tonn, M. Westphal, J.T. Rutka, S.A. Grossman. — Berlin: Springer, 2006. — Р. 145-159, 207-217, 491-499, 505-517, 529-539.
25. Ono M., Rhoton Al.L. Microsurgical Anatomy of the Deep venous System of the Brain // Neurosurgery. — 1984. — V. 15, № 5. — P. 621-657.
26. Ono M., Rhoton Al.L., Barry M. Microsurgical anatomy of the region of the tentorial incisura // J. Neurosurg. — 1980. — V. 60. — P. 365-399.
27. Rhoton Al.L. Microsurgical Anatomy of the Third Ventricular Region // Surgery of the third ventricle / M.L.J. Apuzzo (ed.). — Baltimore: Williams, Wilkins, 1987. — P. 92-167.
28. Rhoton Al.L., Yamamoto I. Microsurgery of the third ventricle // Neurosurgery. — 1981. — V. 8, Part 1. — P. 334-356.
29. Rhoton Al.L., Yamamoto I., Peace D.A. Microsurgery of the third ventricle: Operative approaches // Neurosurgery. — 1981. — V. 8, Part 2. — P. 357-373.
30. Saeki N., Rhoton Al.L. Microsurgical anatomy of the upper basilar artery and the posterior circle of Willis // J. Neurosurg. — 1977. — V. 46. — P. 563-578.
 Самый древний вид спорта в мире
Самый древний вид спорта в мире Владимир Колокольцев: служба в Афгане, борьба с ОПГ и другие факты биографии главы МВД
Владимир Колокольцев: служба в Афгане, борьба с ОПГ и другие факты биографии главы МВД Чем отличается лук шалот от репчатого лука, можно ли заменять их друг другом отличий от репчатого лука
Чем отличается лук шалот от репчатого лука, можно ли заменять их друг другом отличий от репчатого лука Все бабы как бабы, а я – дура на миллион И главный вопрос: какой женщиной для этого нужно быть
Все бабы как бабы, а я – дура на миллион И главный вопрос: какой женщиной для этого нужно быть Эльза скарлетт титания. Перевооружение эльзы. Сердечные тайны Эрзы Скарлетт
Эльза скарлетт титания. Перевооружение эльзы. Сердечные тайны Эрзы Скарлетт Персонаж аниме Эльза Алая: биография, доспехи и интересные факты
Персонаж аниме Эльза Алая: биография, доспехи и интересные факты Самая популярная аниме героиня
Самая популярная аниме героиня