Лечение острого приступа бронхиальной астмы в отделении реанимации. Доказательная медицина в диагностике и лечении бронхиальной астмы Показания к применению В-адреномиметиков
Для цитирования:
Синопальников А.И., Клячкина И.Л. b2-агонисты: роль и место в лечении бронхиальной астмы // РМЖ. 2002. №5. С. 236
Государственный институт усовершенствования врачей МО РФ, Москва
Введение
Терапия бронхиальной астмы (БА) может быть условно разделена на два основных направления. Первое - симптоматическая терапия, быстро и эффективно купирующая бронхоспазм, ведущий клинический симптом БА. Второе - противовоспалительная терапия, способствующая модификации главного патогенетического механизма заболевания, а именно, воспаления слизистой дыхательных путей (ДП) .
Центральное место среди средств симптоматического контроля БА, очевидно, занимают b 2 -агонисты, характеризующиеся выраженной бронхолитической активностью (и бронхопротективным действием) и минимальным числом нежелательных побочных явлений при их правильном использовании.
Краткая история b
2 -агонистов
История применения b
-агонистов в XX веке - это последовательная разработка и внедрение в клиническую практику лекарственных средств со все более возрастающей b
2 -адренергической селективностью и увеличивающейся продолжительностью действия.
Впервые симпатомиметик адреналин (эпинефрин) был использован в лечении больных БА в 1900 г. . Поначалу адреналин широко применялся как в инъекционной форме, так и в виде ингаляций. Однако неудовлетворенность врачей кратковременностью действия (1-1,5 ч), большим количеством негативных побочных эффектов препарата явилась стимулом к дальнейшему поиску более «привлекательных» лекарственных средств.
В 1940 г. появился изопротеренол - синтетический катехоламин. Он разрушался в печени так же быстро, как и адреналин (при участии фермента катехол-о-метилтрансферазы - КОМТ), и поэтому характеризовался небольшой продолжительностью действия (1-1,5 ч), а образующиеся в результате биотрансформации изопротеренола метаболиты (метоксипреналин) обладали b -адреноблокирующим действием. В то же время изопротеренол был свободен от таких нежелательных явлений, присущих адреналину, как головная боль, задержка мочи, артериальная гипертензия и др. Изучение фармакологических свойств изопротеренола привело к установлению гетерогенности адренорецепторов . По отношению к последним адреналин оказался универсальным прямым a -b -агонистом, а изопротеренол - первым короткодействующим неселективным b -агонистом .
Первым селективным b 2 -агонистом стал появившийся в 1970 г. сальбутамол , характеризовавшийся минимальной и клинически незначимой активностью в отношении a - и b 1 -рецепторов. Он по праву приобрел статус «золотого стандарта» в ряду b 2 -агонистов. За сальбутамолом последовало внедрение в клиническую практику других b 2 -агонистов (тербуталин, фенотерол и др.). Эти препараты оказались столь же эффективны в качестве бронхолитиков, как и неселективные b -агонисты, поскольку бронхолитический эффект симпатомиметиков реализуется только через b 2 -адренорецепторы. Вместе с тем b 2 -агонисты демонстрируют существенно менее выраженное стимулирующее воздействие на сердце (батмотропное, дромотропное, хронотропное) по сравнению с b 1 -b 2 -агонистом изопротеренолом .
Некоторые различия в селективности b 2 -агонистов не имеют серьезного клинического значения. Большая частота нежелательных кардиоваскулярных эффектов при приеме фенотерола (по сравнению с сальбутамолом и тербуталином) может быть объяснена большей эффективной дозой препарата и, отчасти, более быстрой системной абсорбцией. У новых препаратов сохранилось быстродействие (наступление эффекта в первые 3-5 минут после ингаляции), характерное для всех предшествующих b -агонистов при заметном увеличении продолжительности их действия до 4-6 часов (менее выраженном при тяжелой БА). Это улучшало возможности контроля за симптомами БА в течение дня, но «не спасало» от ночных приступов .
Появившаяся возможность приема отдельных b 2 -агонистов внутрь (сальбутамол, тербуталин, формотерол, бамбутерол) в некоторой степени решала проблему контроля ночных приступов БА. Однако необходимость принимать значительно более высокие дозы (почти в 20 раз больше, чем при ингаляционном применении) способствовала появлению нежелательных явлений, связанных со стимуляцией a - и b 1 -адренорецепторов. Кроме того, была выявлена и более низкая терапевтическая эффективность этих препаратов .
Значительно изменило возможности терапии БА появление пролонгированных ингаляционных b 2 -агонистов - сальметерола и формотерола. Первым появился на рынке сальметерол - высокоселективный b 2 -агонист, демонстрирующий продолжительность действия, по крайней мере, в течение 12 часов, но с медленным началом действия. Вскоре к нему «присоединился» формотерол , также являющийся высокоселективным b 2 -агонистом с 12-часовым действием, но со скоростью развития бронходилатационного эффекта, аналогичной таковой сальбутамола . Уже в первые годы применения пролонгированных b 2 -агонистов было отмечено, что они способствуют урежению обострений БА, уменьшению количества госпитализаций, а также снижению потребности в ингаляционных кортикостероидах (ИГКС).
Наиболее эффективным путем введения лекарственных препаратов при БА, в том числе и b 2 -агонистов, признан ингаляционный. Важными преимуществами этого пути являются возможность непосредственной доставки лекарственных препаратов к органу-мишени (что в значительной степени обеспечивает быстродействие бронходилататоров) и минимизация нежелательных эффектов. Из известных в настоящее время средств доставки наиболее часто используются дозированные аэрозольные ингаляторы (ДАИ), реже дозированные порошковые ингаляторы (ДПИ) и небулайзеры. Пероральные b 2 -агонисты в виде таблеток или сиропов применяются крайне редко, главным образом как дополнительное средство при частых ночных симптомах БА или высокой потребности в ингаляционных короткодействующих b 2 -агонистах у больных, получающих высокие дозы ИГКС (эквивалентные 1000 мкг беклометазона в сутки и более) .
Механизмы действия b
2 -агонистов
b
2 -агонисты вызывают бронходилатацию в первую очередь в результате непосредственной стимуляции b
2 -адренорецепторов гладких мышц ДП. Доказательства этого механизма были получены как in vitro
(при воздействии изопротеренола происходило расслабление бронхов человека и отрезков легочной ткани), так и in vivo
(быстрое падение сопротивления ДП после ингаляций бронхолитика) .
Стимуляция b -адренорецепторов приводит к активации аденилатциклазы, образущей комплекс с G-протеином (рис.1), под воздействием которого повышается содержание внутриклеточного циклического аденозин-3,5-монофосфата (цАМФ). Последнее приводит к активации специфической киназы (протеинкиназы А), которая фосфорилирует некоторые внутриклеточные белки, в результате чего происходит снижение внутриклеточной концентрации кальция (активное его «перекачивание» из клетки во внеклеточное пространство), тормозится гидролиз фосфоинозитида, ингибируются киназы легких цепей миозина и, наконец, «открываются» большие кальций-активируемые калиевые каналы, обусловливающие реполяризацию (расслабление) гладкомышечных клеток и секвестрацию кальция во внеклеточное депо. Нужно сказать, что b 2 -агонисты могут связываться с калиевыми каналами и непосредственно вызывать релаксацию гладкомышечных клеток независимо от повышения внутриклеточной концентрации цАМФ .
Рис.1. Молекулярные механизмы, участвующие в бронходилатационном эффекте b 2 -агонистов (объяснения в тексте). К Са - большой кальцийактивируемый калиевый канал; АТФ - аденозинтрифосфат; цАМФ - циклический аденозин-3,5-моносфат
b 2 -агонисты рассматриваются как функциональные антагонисты, обусловливающие обратное развитие бронхоконстрикции вне зависимости от имевшего место констрикторного воздействия. Это обстоятельство представляется чрезвычайно важным, поскольку многие медиаторы (медиаторы воспаления и нейротрансмиттеры) обладают бронхоконстрикторным действием.В результате воздействия на b -адренорецепторы, локализующиеся в различных отделах ДП (табл. 1), выявляются дополнительные эффекты b 2 -агонистов, которые объясняют возможность профилактического использования препаратов. В их числе угнетение высвобождения медиаторов из клеток воспаления, уменьшение проницаемости капилляров (предотвращение развития отека слизистой бронхов), угнетение холинергической передачи (уменьшение холинергической рефлекторной бронхоконстрикции), модуляция продукции слизи подслизистыми железами и, следовательно, оптимизация мукоцилиарного клиренса (рис. 2).
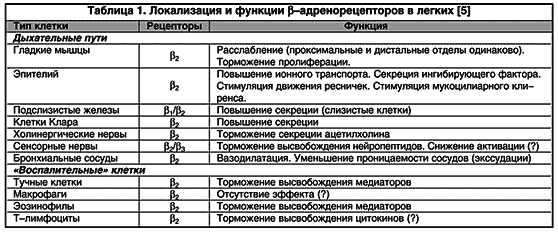

Рис. 2. Прямой и непрямой бронходилатационный эффект b 2 -агонистов (объяснения в тексте). Э - эозинофил; ТК - тучная клетка; ХН - холинергический нерв; ГмК - гладкомышечная клетка
Согласно микрокинетической диффузионной теории G.Andersen , продолжительность и время начала действия b 2 -агонистов связаны с их физико-химическими свойствами (в первую очередь липофильностью/гидрофильностью молекулы) и особенностями механизма действия. Сальбутамол - гидрофильное соединение. Попадая в водную среду внеклеточного пространства, он быстро проникает в «сердцевину» рецептора и после прекращения связи с ним удаляется путем диффузии (рис. 3). Сальметерол , созданный на основе сальбутамола, высоко липофильный препарат, быстро проникает в мембраны клеток дыхательных путей, выполняющих функцию депо, и затем медленно диффундирует через мембрану рецептора, обусловливая его длительную активацию и более позднее начало действия. Липофильность формотерола меньше, чем у сальметерола, поэтому он образует депо в плазматической мембране, откуда диффундирует во внеклеточную среду и затем одновременно связывается с b -адренорецептором и липидами, что обусловливает и быстроту наступления эффекта, и увеличение его продолжительности (рис. 3). Продолжительный эффект сальметерола и формотерола объясняется их способностью длительное время находиться в бислое клеточных мембран гладкомышечных клеток в непосредственной близости от b 2 -адренорецепторов и взаимодействовать с последними.

Рис. 3. Механизм действия b 2 -агонистов (объяснения в тексте)
При исследовании in vitro спазмированная мышца расслабляется быстрее при добавлении формотерола, нежели сальметерола. Это подтверждает то, что сальметерол является частичным агонистом b 2 -рецепторов относительно формотерола .
Рацематы
Селективные b
2 -агонисты представляют из себя рацемические смеси (50:50) двух оптических изомеров - R и S. Установлено, что фармакологическая активность R-изомеров в 20-100 раз выше, чем S-изомеров. Показано, что R-изомер сальбутамола проявляет свойства бронхолитика. В то же время S-изомер проявляет прямо противоположные свойства: провоспалительное действие, увеличение гиперреактивности ДП, усиление бронхоспазма, кроме того, он значительно медленнее метаболизируется. Недавно был создан новый препарат, содержащий только R-изомер (левалбутерол
). Он существует пока только в растворе для небулайзеров и имеет лучший терапевтический эффект, чем рацемический сальбутамол , так как эквивалентный эффект левалбутерол демонстрирует в дозе, равной 25% рацемической смеси (нет противодействующего S-изомера, уменьшено и количество нежелательных явлений) .
Селективность b
2 -агонистов
Цель применения селективных b
2 -агонистов состоит в том, чтобы обеспечить бронходилатацию и при этом избежать нежелательных явлений, индуцируемых стимуляцией a
- и b
1 -рецепторов. В большинстве случаев умеренное применение b
2 -агонистов не ведет к развитию нежелательных эффектов. Однако селективность не может полностью устранить риск их развития, и тому есть несколько объяснений.
Прежде всего, селективность к b 2 -адренорецепторам всегда относительна и дозозависима. Незначительная активация a - и b 1 -адренорецепторов, незаметная при обычных среднетерапевтических дозах, становится клинически значимой при увеличении дозы препарата или частоты его приема в течение дня. Дозозависимый эффект b 2 -агонистов необходимо учитывать при лечении обострений БА, особенно жизнеугрожающих состояний, когда повторные ингаляции в течение короткого времени (нескольких часов) в 5-10 раз превышают допустимую суточную дозу.
b 2 -рецепторы широко представлены в ДП (табл. 1). Плотность их увеличивается по мере уменьшения диаметра бронхов, а у больных БА плотность b 2 -рецепторов в дыхательных путях выше, чем у здоровых. Многочисленные b 2 -адренорецепторы найдены на поверхности тучных клеток, нейтрофилов, эозинофилов, лимфоцитов . И в то же время b 2 -рецепторы находят в разнообразных тканях и органах, особенно в левом желудочке, где они составляют 14% всех b -адренорецепторов, и в правом предсердии - 26% всех b -адренорецепторов . Стимуляция этих рецепторов может привести к развитию нежелательных явлений, включая тахикардию, трепетание предсердий и ишемию миокарда. Стимуляция b 2 -рецепторов скелетных мышц может вызвать мышечный тремор. Активация больших калиевых каналов может способствовать развитию гипокалиемии и, как следствие этого - удлинению интервала QT и нарушениям сердечного ритма, в т.ч. фатальным. При системном введении больших доз препаратов могут наблюдаться метаболические эффекты (увеличение уровня свободных жирных кислот в сыворотке крови, инсулина, глюкозы, пирувата и лактата) .
При стимуляции сосудистых b 2 -рецепторов развивается вазодилатация и возможно снижение диастолического артериального давления. Особенно выражены нежелательные кардиальные эффекты в условиях тяжелой гипоксии во время обострений БА - увеличение венозного возврата (особенно в положении ортопноэ) может вызвать развитие синдрома Bezold-Jarisch с последующей остановкой сердца .
Связь между b
2 -агонистами и воспалением в ДП
В связи с широким использованием b
2 -агонистов короткого действия, а также внедрением в клиническую практику пролонгированных ингаляционных b
2 -агонистов стал особенно актуальным вопрос о том, обладают ли эти препараты противовоспалительным действием. Несомненно, противовоспалительным эффектом b
2 -агонистов, способствующим модификации острого воспаления бронхов, можно считать угнетение высвобождения медиаторов воспаления из тучных клеток и уменьшение проницаемости капилляров. В то же время при биопсии слизистой бронхов больных БА, регулярно принимающих b
2 -агонисты, было установлено, что число клеток воспаления, в т.ч. и активированных (макрофаги, эозинофилы, лимфоциты) не уменьшается .
При этом теоретически регулярный прием b 2 -агонистов может даже привести к усугублению воспаления в ДП. Так, обусловливаемая b 2 -агонистами бронходилатация позволяет осуществить более глубокий вдох, результатом чего может стать более массивная экспозиция аллергенов.
Кроме того, регулярное применение b 2 -агонистов может маскировать развивающееся обострение, тем самым задерживая начало или усиление истинной противовоспалительной терапии.
Потенциальный риск использования b
2 -агонистов
Толерантность
Частое регулярное применение ингаляционных b
2 -агонистов может привести к развитию толерантности (десенситизации) к ним. Накопление цАМФ способствует переходу рецептора в неактивное состояние. Чрезмерно интенсивная стимуляция b
-адренорецепторов способствует развитию десенситизации (уменьшению чувствительности рецепторов в результате разобщения рецептора с G-протеином и аденилатциклазой) . При сохранении избыточной стимуляции уменьшается число рецепторов на поверхности клетки («down»-регуляция). Нужно отметить, что b
-рецепторы гладких мышц ДП имеют довольно значительный резерв и поэтому они более устойчивы к десенситизации, чем рецепторы нереспираторных зон (например, скелетной мускулатуры или регулирующие метаболизм). Установлено, что у здоровых лиц быстро развивается толерантность к высоким дозам сальбутамола, а к фенотеролу и тербуталину - нет. Вместе с тем у больных БА толерантность к бронхолитическому эффекту b
2 -агонистов появляется редко, гораздо чаще развивается толерантность к их бронхопротективному действию.
Уменьшение бронхопротективного действия b 2 -агонистов при их регулярном, частом применении в равной степени касается и короткодействующих, и пролонгированных препаратов даже на фоне базисной терапии ингаляционными кортикостероидами. В то же время речь идет не о полной потере бронхопротекции, а о небольшом снижении ее первоначального уровня. H.J.van der Woude et al. установили, что на фоне регулярного применения больными БА формотерола и сальметерола бронхолитический эффект последних не снижается, бронхопротективное действие оказывается выше у формотерола, но при этом значительно меньше выражено бронхолитическое действие сальбутамола.
Десенситизация развивается длительно, в течение нескольких дней или недель, в отличие от тахифилаксии, которая развивается очень быстро и не связана с функциональным состоянием рецепторов. Это обстоятельство объясняет снижение эффективности лечения и требует ограничения частоты применения b 2 -агонистов .
Индивидуальную вариабельность ответа на b 2 -агонисты и развития толерантности к их бронходилатирующему эффекту многие исследователи связывают с генетическим полиморфизмом генов. Ген b 2 -адренорецепторов локализуется на 5q хромосоме. Существенное влияние на течение БА и эффективность лечения оказывает изменение аминокислотной последовательности b 2 -адренорецепторов, в частности, перемещение аминокислот в 16 и 27 кодонах. Влияние полиморфизма генов не распространяется на вариабельность бронхопротективного эффекта. Справедливости ради надо отметить, что эти данные подтверждаются не во всех работах .
b 2 -агонисты и смертность больных БА
Серьезные сомнения в безопасности ингаляционных b -агонистов возникли в 60-х годах ХХ столетия, когда в ряде стран, в том числе Англии, Австралии, Новой Зеландии разразилась «эпидемия смертей» среди больных БА . При этом высказывалось предположение о связи между терапией симпатомиметиками и увеличением смертности от БА. Причинно-следственные взаимоотношения между применением b -агонистов (изопротеренола) и возросшей смертностью тогда не были установлены, а по результатам ретроспективных исследований доказать их было практически невозможно. Связь же между приемом фенотерола и повышением смертности от БА в Новой Зеландии в 80-е годы удалось доказать, поскольку было установлено, что этот препарат чаще назначался в случаях фатальной БА, по сравнению с хорошо контролируемым заболеванием. Эта связь была косвенно подтверждена и снижением смертности, совпавшей с отменой широкого приема фенотерола (при общем увеличении продаж других b 2 -агонистов). В этом плане показательны результаты эпидемиологического исследования в Канаде, ставившего своей целью изучить возможную связь между частотой летальных исходов и назначаемыми лекарственными средствами . Было показано, что возрастание частоты летальных исходов ассоциируется с высокодозной терапией любым из доступных ингаляционных b 2 -агонистов. Риск фатального исхода был наибольшим при применении фенотерола, однако при упорядоченном сравнении с эквивалентными дозами сальбутамола показатели смертности достоверно не отличались.
В то же время связь между высокодозной терапией b 2 -агонистами и увеличением смертности от БА надежно доказать не удается, поскольку больные с более тяжелой и плохо контролируемой БА чаще прибегают к помощи высоких доз b 2 -агонистов и, напротив, реже - к помощи эффективных противовоспалительных лекарственных средств. Кроме того, высокие дозы b 2 -агонистов маскируют признаки нарастающего фатального обострения БА .
Режим дозирования
Ингаляционные короткодействующие b
2 -агонисты
Не вызывает сомнений тот факт, что ингаляционные короткодействующие b
2 -агонисты являются препаратами выбора для ситуационного симптоматического контроля БА , а также для предупреждения развития симптомов астмы физического усилия (АФУ). Регулярное же применение ингаляционных b
-агонистов может привести к утрате адекватного контроля над течением заболевания. Так, в исследовании, проведенном M.R. Sears et al. в Новой Зеландии , изучались бронхиальная гиперреактивность, утренняя ПСВ, ежедневные симптомы и потребность в ИГКС у пациентов, использующих b
2 -агонисты «по требованию», по сравнению с больными, применяющими фенотерол регулярно 4 раза в день. В группе больных с регулярным приемом фенотерола наблюдался плохой контроль над симптомами БА, кроме того, отмечались более частые и тяжелые обострения по сравнению с группой больных, применяющих b
2 -агонисты «по требованию» в течение полугода. У последних же наблюдались улучшение показателей функции внешнего дыхания, утренней ПСВ, снижение ответа на бронхопровокационную пробу с метахолином. Повышение гиперреактивности бронхов на фоне регулярного приема короткодействующих b
2 -агонистов, скорее всего, связано с наличием S-энантомеров в рацемической смеси препарата .
В отношении сальбутамола подобные закономерности установить не удалось, хотя, как и в случае с фенотеролом, его регулярный прием сопровождался незначительным возрастанием бронхиальной гиперреактивности. Имеются отдельные доказательства того, что регулярное применение сальбутамола сопровождается возрастанием частоты эпизодов АФУ и увеличением выраженности воспаления в ДП .
Короткодействующие b 2 -агонисты должны использоваться (в т.ч. и в рамках монотерапии) только «по требованию». Маловероятно, что обычно рекомендуемый режим дозирования b 2 -агонистов «по требованию» может ухудшить контроль над течением БА, однако при использовании высоких доз препарата ухудшение контроля становится реальным. Более того, многие больные становятся особенно чувствительными к агонистам при наличии полиморфизма b 2 -адренорецепторов, что обусловливает более быстрое ухудшение контроля . Связь, установленная между повышением риска смерти у больных БА и применением высоких доз ингаляционных b 2 -агонистов, отражает лишь степень тяжести заболевания. Возможно также, что высокие дозы ингаляционных b 2 -агонистов оказывают вредоносное воздействие на течение БА . Больные, получающие высокие дозы b 2 -агонистов (более 1,4 баллончика аэрозоля в месяц), безусловно, нуждаются в эффективной противовоспалительной терапии, в т.ч. и с целью уменьшения дозы b 2 -агонистов . При увеличении потребности в бронходилататорах (чаще трех раз в неделю) показано дополнительное назначение противовоспалительных препаратов, а при употреблении b 2 -агонистов более 3-4 раз в день для купирования симптомов - увеличение их дозы.
Прием короткодействующих b 2 -агонистов с целью бронхопротекции также ограничивается «разумными пределами» (не более 3-4 раз в сутки). Бронхопротективные свойства b 2 -агонистов позволяют многим высококвалифицированным спортсменам, страдающим БА, выступать в соревнованиях международного уровня (правила позволяют использовать короткодействующие b 2 -агонисты для профилактики АФУ при условии, что заболевание врачебно верифицировано). Так, например, на Олимпийских играх 1984 г. в Лос-Анджелесе принимали участие 67 спортсменов с АФУ, из которых 41 получил медали разного достоинства . Известно, что пероральные b 2 -агонисты способствуют повышению работоспособности за счет увеличения мышечной массы, белкового и липидного анаболизма, психостимуляции . В исследовании С.Goubart et al. было показано, что влияние ингаляционных b 2 -агонистов у здоровых спортсменов ограничивается лишь небольшой бронходилатацией, которая, впрочем, может вносить существенный вклад в улучшение дыхательной адаптации в начале нагрузки.
Пролонгированные ингаляционные b 2 -агонисты
Доступные в настоящее время пролонгированные ингаляционные b 2 -агонисты - формотерол и сальметерол оказывают свое действие в течение 12 часов с равноценным бронхолитическим эффектом. Тем не менее различия между ними есть. В первую очередь, это быстродействие формотерола (в форме ДПИ), сопоставимое со временем начала действия сальбутамола (в форме ДАИ) , что позволяет использовать формотерол в качестве средства скорой помощи, вместо короткодействующих b 2 -агонистов. В то же время нежелательных явлений при использовании формотерола существенно меньше, чем при применении сальбутамола . Эти препараты могут использоваться в качестве монотерапии у больных с легким течением БА в качестве бронхопротекторов при АФУ. При использовании формотерола чаще 2 раз в неделю «по требованию» необходимо добавлять к лечению ИГКС.
Следует отметить, что монотерапия пролонгированными b 2 -агонистами на регулярной основе не рекомендуется, так как до сих пор нет надежных доказательств их противовоспалительного, модифицирующего заболевание действия .
Есть научно обоснованные доказательства целесообразности комбинированного применения ИГКС и бронходилататоров. Кортикостероиды усиливают экспрессию b 2 -рецепторов и уменьшают потенциальную десенситизацию, в то время как пролонгированные b 2 -агонисты увеличивают чувствительность кортикостероидных рецепторов к ИГКС .
Проведенные к настоящему времени исследования свидетельствуют о возможности более раннего назначения пролонгированных ингаляционных b 2 -агонистов. Так, например, у больных с неадекватным контролем астмы на фоне приема 400-800 мкг ИГКС дополнительное назначение сальметерола обеспечивает более полный и адекватный контроль по сравнению с увеличением дозы ИГКС. Формотерол демонстрирует сходный эффект и одновременно способствует уменьшению частоты обострений заболевания. Эти и ряд других исследований свидетельствуют о том, что добавление пролонгированных ингаляционных b 2 -агонистов к низко-среднедозовой терапии ИГКС у больных с неадекватным контролем БА равноценно удвоению дозы стероидов .
В настоящее время рекомендовано использовать пролонгированные ингаляционные b 2 -агонисты только у больных, одновременно получающих ИГКС. Многообещающими представляются фиксированные комбинации, такие как сальметерол с флютиказоном (Серетид) и формотерол с будесонидом (Симбикорт). При этом отмечается лучшая комплаентность, исключается риск использования только одного из препаратов в рамках длительной терапии заболевания.
Литература:1. National Institutes of Health, National Heart, Lung, and Blood Institute. Expert Panel Report 2: Guidelines for the Diagnosis and Management of Asthma. Bethesda, Md: National Institutes of Health, National Heart, Lung, and Blood Institute; April 1997. NIH publication 97-4051.
2. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. В 2-х томах. Москва: Медицина; 1991 г.
3. Машковский М.Д. Лекарственные средства. Москва: Медицина; 1984 г.
4. Show M. B2-agonists, from pharmacological properties to everyday clinical practice. International workshop report (based on a workshop held in London, UK February 28-29, 200)
5. Barnes P.J. b -Agonists, Anticholinergics, and Other Nonsteroid Drugs. In: Albert R., Spiro S., Jett J., editors. Comprehensive Respiratory Medicine. UK:Harcourt Publishers Limited; 2001. p.34.1-34-10
6. Updating guidelines on asthma in adults (editorial). BMJ 2001; 323:1380-1381.
7. Jonson M. b 2 -adrenoceptor agonists: optimal pharmacological profile. In: The role of b 2 -agonists in asthma management. Oxford: The Medicine Group; 1993. p. 6-8.
8. Barnes P.J. beta-adrenergic receptors and their regulation. Am J Respir Crit Care Med. 1995; 152:838-860.
9. Kume H., Takai A., Tokuno H., Tomita T. Regulation of Ca 2 + dependent K+-channel activity in tracheal myocytes by phosphorylation. Nature 1989; 341:152-154.
10. Anderson G.P. Long acting inhaled beta-adrenoceptor agonists: the comparative pharmacology of formoterol and salmeterol. Agents Actions Suppl. 1993; 43:253-269.
11. Stiles GL, Taylor S, Lefkowitz RJ. Human cardiac beta-adrenergic receptors: subtype heterogeneity delineated by direct radioligand binding. Life Sci. 1983; 33:467-473.
12. Prior JG, Cochrane GM, Raper SM, Ali C, Volans GN. Self-poisoning with oral salbutamol. BMJ. 1981; 282:1932.
13. Handley D. The asthma-like pharmacology and toxicology of (S)-isomers of beta agonists. J Allergy Clin Immunol. 1999;104: S69-S76.
14. .Jonson M., Coleman R. Mechanisms of action beta-2-adrenoceptor agonists. In: Bisse W., Holgate S., editorials. Asthma and Rhinitis. Blackwell Science; 1995. p.1278-1308.
15. Burggsaf J., Westendorp R.G.J., in’t Veen J.C.C.M et al. Cardiovascular side effects of inhaled salbutamol in hypoxic asthmatic patients. Thorax 2001; 56: 567-569.
16. Van Shayck C.P., Bijl-Hoffland I.D., Closterman S.G.M. et al. Potential masking effect on dispnoea perception by short- and long-acting b 2 -agonists in asthma. ERJ 2002; 19:240-245.
17. Van der Woude H.J., Winter T.N., Aalbers R. Decreased bronchodilating effect of salbutamol in relieving methacholine induced moderate to severe bronchoconstriction during high dose treatment with long acting b 2 agonists. Thorax 2001; 56: 529-535.
18. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol. 1999; 104:S77-S84.
19. Lipworth BJ, Hall IP, Tan S, Aziz I, Coutie W. Effects of genetic polymorphism on ex vivo and in vivo function of b 2 -adrenoceptors in asthmatic patients. Chest 1999;115:324-328.
20. Lipworth BJ, Kopelman G.H., Wheatley A.P. et al. b 2 -adrenoceptor promoter polymorphism: extended halotypes and functional effects in peripheral blood mononuclear cells. Thorax 2002; 57: 61-66.
21. Lima JJ, Thomason DB, Mohamed MH, Eberle LV, Self TH, Johnson JA. Impact of genetic polymorphisms of the b 2 -adrenergic receptor on albuterol bronchodilator pharmacodynamics. Clin Pharm Ther 1999; 65:519-525.
22. Kotani Y, Nishimura Y, Maeda H, Yokoyama M. b 2 -adrenergic receptor polymorphisms affect airway responsiveness to salbutamol in asthmatics. J Asthma 1999; 36:583-590.
23. Taylor D.R., Sears M.R., Cockroft D.W. The beta-agonist controversy. Med Clin North Am 1996; 80: 719-748.
24. Spitzer WO, Suissa S, Ernst P, et al. The use of beta-agonists and the risk of death and near death from asthma. N Engl J Med 1992; 326:501-506.
25. Sears MR, Taylor DR, Print CG, et al. Regular inhaled beta-agonist treatment in bronchial asthma. Lancet 1990; 336:1391-1396.
26. Handley D. The asthma-like pharmacology and toxicology of (S)-isomers of beta agonists. J Allergy Clin Immunol. 1999; 104:S69-S76.
27. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol 1999;104:S77-S84.
28. Liggett S.B. Polymorphisms of the b 2 -adrenergic receptor in asthma. Am J Respir Cri. Care Med 1997; 156: S 156-162.
29. Voy R.O. The US Olympic Commitee experience with exercise-induced bronchospasm. Med Sci Exerc 1986; 18:328-330.
30. Lafontan M, Berlan M, Prud’hon M. Les agonistes beta-adrenergiques. Mecanismes d’action: lipomobilisation et anabolisme. Reprod Nutr Develop 1988; 28:61-84
31. Martineau L, Horan MA, Rothwell NJ, et al. Salbutamol, a b 2 -adrenoceptor agonist, increases skeletal muscle strength in young men. Clin Sci 1992; 83: 615-621.
32. Price AH, Clissold SP. Salbutamol in the 1980s. A reappraisal of its clinical efficacy. Drugs 1989; 38: 77-122.
33. Goubault C, Perault M-C, Leleu et al. Effects of inhaled salbutamol in exercising non-asthmatic athletes Thorax 2001; 56: 675-679.
34. Seberova E, Hartman P, Veverka J, et al. Formoterol given by Turbuhaler® had a rapid onset of action as salbutamol given by pMDI. Program and abstracts of the 1999 International Conference of the American Thoracic Society; April 23-28, 1999; San Diego, California. Abstract A637.
35. Wallin A., Sandstrom T., Soderberg M. et al. The effects of regular inhaled formoterol, budesonide, and placebo on mucosal inflammation and clinical indices of mild asthma. Am J Respir Crit Care Med. 1998; 158:79-86.
36. Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher-dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen & Hanburys Limited UK Study Group. Lancet. 1994; 334:219-224.
Страницы: 1
Пролонгированные beta2-агонисты: место в терапии обструктивных болезней легких
С.Н.Авдеев, З.Р.Айсанов
НИИ пульмонологии Минздрава РФ, Москва
Список сокращений
А гонисты b 2 -адренергических рецепторов (b 2 -агонисты) являются самыми эффективными бронхорасширяющими препаратами, известными на сегодняшний день. Данные препараты способны быстро и эффективно уменьшить одышку, связанную с бронхоконстрикцией, и поэтому находят широкое применение при терапии наиболее распространенных обструктивных заболеваниях легких – бронхиальной астмы (БА) и хронической обструктивной болезни легких (ХОБЛ). Совершенствование b 2 -адренергических бронходилататоров шло по трем основным направлениям: создание селективных препаратов с большим сродством к b 2 -рецепторам, прямая доставка препарата к органу-мишени для снижения активации рецепторов в других тканях и создание препаратов длительного действия. Одним из заметных достижений в области создания b 2 -агонистов стало внедрение в клиническую практику b 2 -агонистов длительного действия (более 12 ч) – сальметерола и формотерола, каждый из которых уже показал свою высокую эффективность при БА и при ХОБЛ.
Описание препаратов и механизм действия
Формотерол был синтезирован на основе фенилэтаноламина и изначально использовался как оральный препарат, позже было обнаружено, что он обладает длительным эффектом при ингаляционном пути введения. Сальметерол, относящийся к классу салигенинов, был создан на основе сальбутамола. Его пролонгированный эффект был достигнут в результате удлинения липофильного "хвоста" (рис. 1).
Механизм действия пролонгированных
b
2 -агонистов на уровне рецепторов отличается от действия
b
2 -агонистов короткого действия. Согласно микрокинетической диффузионной гипотезе G.Anderson липофильность сальметерола и формотерола является наиболее важным фактором, объясняющим их отличия от других препаратов данного класса. Вследствие своей очень высокой липофильности сальметерол быстро проникает в мембраны клеток дыхательных путей, и эти мембраны выполняют функцию депо для препарата. Данный эффект снижает скорость поступления сальметерола к гладким мышцам и функциональным
b
2 -рецепторам, так как сначала препарат проникает в мембраны других (негладкомышечных) клеток. Формотерол по сравнению с сальметеролом обладает много меньшей липофильностью, поэтому значительная доля молекул препарата остается в водной фазе и более быстро проходит через стенку дыхательных путей к
b
2 -рецепторам гладких мышц, что ведет к быстрому развитию бронхорасширяющего эффекта. Продолжительный эффект сальметерола и формотерола объясняется их способностью длительное время находиться в би-слое клеточных мембран гладкомышечных клеток, в непосредственной близости от
b
2 -рецепторов и взаимодействовать с этими рецепторами (рис. 2).
Таблица 1. Селективность некоторых агонистов
b
2
-адренергических рецепторов
| Препарат | Активность* гладкомышечные клетки бронхов ( b 2 -рецептор) |
Активность* сердечная ткань ( b 1 -рецептор) |
Отношение селективности |
| Изопреналин | |||
| Фенотерол |
0,005 |
||
| Сальбутамол |
0,55 |
0,0004 |
1375 |
| Формотерол |
20,0 |
0,05 |
|
| Сальметерол |
0,0001 |
85 000 |
|
| *Активность по отношению к изопреналину (= 1,0) | |||
Рис. 1. Химическая структура агонистов b 2 -адренергических рецепторов.
Существует еще одна гипотеза продолжительного действия сальметерола (гипотеза якорной связи): возможно, что длинный липофильный "хвост" препарата взаимодействует со специфической гидрофобной связывающей областью
b
2 -рецептора, попеременно и длительно связывая активный сайт области рецептора.
Оба препарата относятся к высокоселективным агонистам
b
2 -адренергических рецепторов (табл. 1). Несмотря на сходный фармакологический профиль, данные препараты имеют и определенные различия. Основным отличием препаратов является скорость развития терапевтического эффекта: начало действия формотерола такое же быстрое, как у сальбутамола – через 1–3 мин после ингаляции, в то
время как эффект сальметерола появляется через 10–20 мин (рис. 3). Продолжительность бронхорасширяющего эффекта двух препаратов примерно одинаковая – более 12 ч (рис. 4), хотя in vitro действие формотерола более короткое, чем у сальметерола. Интересно также отметить зависимость продолжительности действия формотерола от его дозы: М.Palmquist и соав. показали, что повышение объема форсированного выдоха за одну секунду (ОФВ
1 ) выше 15% после ингаляции формотерола продолжалось 244, 337 и 459 мин при использовании доз препарата 6, 12 и 24 мкг соответственно.
Сальметерол и формотерол различаются по своему максимальному эффекту расслабления гладкой мускулатуры дыхательных путей. Сальметерол является парциальным (частичным) агонистом
b
2 -рецепторов. Несмотря на то что сальметерол обладает внутренней активностью (intrinsic activity), он не способен вызвать полное расслабление сокращенной гладкой мускулатуры по сравнению с полным агонистом – формотеролом. Кроме того, полный агонист формотерол обладает большим бронхопротективным эффектом против прямых бронхоконстрикторных стимулов. Более высокая бронходилатирующая эффективность формотерола может быть ассоциирована с большим числом побочных эффектов, включая более выраженный и снижение сывороточного калия. Однако в отличие от бронхорасширяющего системный эффект формотерола довольно короткий и не превышает таковой у сальбутамола или тербуталина. Клиническое значение данных различий сальметерола и формотерола пока неясно, хотя теоретически возможно, что полный агонист формотерол может оказаться более эффективным бронхорасширяющим препаратом у больных с тяжелыми формами БА и ХОБЛ. Также возможно, что парциальный агонист сальметерол может препятствовать развитию бронхорасширяющего действия
b
2 -агонистов короткого действия (сальбутамола), хотя проведенные клинические исследования не подтверждают данной гипотезы.
Сальметерол выпускается в виде дозированного ингалятора и в виде порошковых ингаляторов, формотерол только в форме порошковых ингаляторов.
Сходства и различия
b
2 -агонистов короткого и длительного действия представлены в табл. 2.
Пролонгированные
b
2
-агонисты при БА
Пролонгированные
b
2 -агонисты благодаря улучшенному фармакологическому профилю имеют особые преимущества при терапии больных БА. Сальметерол и формотерол обладают бронходилатирующим и бронхопротективными эффектами продолжительностью более 12 ч, что дает возможность назначать эти препараты для терапии ночной астмы. Кроме того, пролонгированные препараты обеспечивают лучший контроль симптомов
и функциональных легочных показателей у больных БА по сравнению с
b
2 -агонистами короткого действия, улучшают качество жизни больных БА, обладают выраженным протективным эффектом при астме физического усилия.
Влияние пролонгированных
b
2
-агонистов на симптомы и функциональные показатели
Эффективность пролонгированных
b
2 -агонистов при БА была доказана многочисленными контролируемыми исследованиями. В трех сходных по своему дизайну Североамериканских, рандомизированных двойных слепых исследованиях у 784 больных БА легкого и среднего течения на протяжении 12 нед проводили сравнение эффективности сальметерола в дозе 42 мкг (эквивалентно дозе 50 мкг в Европе) 2 раза в сутки, сальбутамола 180 мкг (эквивалентно дозе 200 мкг в Европе) 4 раза в сутки и плацебо. Около половины всех больных БА принимали ингаляционные стероиды. Терапия сальметеролом оказалась более эффективной по влиянию на утренние и вечерние показатели пиковой объемной скорости (ПОС), клинические симптомы БА, потребность в симпатомиметиках короткого действия, причем эффективность сальметерола не уменьшалась к концу периода исследования.
Сходные результаты были получены также в крупном многоцентровом Европейском исследовании, включавшем 667 больных БА средней тяжести, однако в данном исследовании около 77% больных принимали кортикостероиды, 50% использовали высокие дозы (более 1000 мкг) ингаляционных стероидов и около 15% принимали оральные стероиды. В Европейском исследовании также сравнивали сальметерол и сальбутамол. Снижение вариабельности показателя ПОС было отмечено только у больных, принимавших сальметерол, и, особенно важно, повышение ОФВ
1 после ингаляции сальметерола наблюдали на протяжении всех 12 мес терапии, т.е. препарат обеспечивал продолжительный контроль БА.
Изучение эффективности другого пролонгированного
b
2 -агониста формотерола проводили в двух рандомизированных слепых исследованиях, включавших в общей сложности 449 больных БА. В данных исследованиях на протяжении 12 нед сравнивали формотерол в дозах 12 мкг 2 раза в сутки и сальбутамол 200 мкг 4 раза в сутки. Терапия формотеролом приводила к улучшению клинических симптомов астмы, повышению утренних показателей ПОС, уменьшению дневной вариабельности ПОС, и в одном из исследований общее число тических атак в неделю было значительно ниже у больных, принимавших формотерол, по сравнению с сальбутамолом (1,7 и 2,8 соответственно, p < 0,05). Последующее наблюдение за больными, продолжающими прием формотерола в течение 12 мес, показали, что эффект, достигнутый к концу 3 мес терапии,
поддерживается на том же уровне длительное время.
Влияние пролонгированных
b
2
-агонистов на качество жизни
Важнейшим параметром оценки эффективности медикаментозных препаратов является качество жизни, основанное на субъективной оценке пациентом своего состояния. Кроме влияния на симптомы и функциональные показатели пролонгированные
b
2 -агонисты способны также улучшить качество жизни больных. В крупном рандомизированном двойном слепом исследовании J.Kemp и соавт. изучали влияние терапии сальметеролом и плацебо на качество жизни, оцениваемое по анкете Asthma Quality of Life, в течение 12 нед у 506 больных БА, принимавших ингаляционные кортикостероиды (ИКС). Терапия сальметеролом по сравнению с плацебо привела к достоверному улучшению общей оценки качества
жизни больных (1,08 и 0,61 баллов соответственно) и отдельных показателей: ограничение активности (0,91 и 0,54 баллов), симптомы астмы (1,28 и 0,71 баллов), эмоциональное благополучие (1,17 и 0,65 баллов), толерантность к внешним стимулам (0,84 и 0,47 баллов). Улучшение качества жизни больных сопровождалось улучшением функциональных показателей, симптомов астмы и снижением потребности в бронходилататорах короткого действия.
Изучению влияния комбинации формотерола и будесонида на качество жизни больных БА, включенных в исследование FACET, было посвящено исследование Е.Juniper, (детали исследования FACET описаны ниже). Качество жизни (оцененное по опроснику Asthma Quality of Life) улучшилось только у больных, получавших комбинированную терапию (на 0,21 балла; p = 0,028), и данное улучшение сохранялось в течение 12 мес активной терапии. Изменения показателей качества жизни коррелировали с улучшением клинических показателей (максимальный коэффициент корреляции – r = 0,51). Во многих исследованиях пациенты предпочитали использование пролонгированных
b
2 -агонистов препаратам короткого действия.
Пролонгированные
b
2
-агонисты при ночной астме
Ночные симптомы (кашель, удушье, диспноэ) являются одной из сложных проблем для многих больных БА. В одном из исследований было показано, что 73% больных БА просыпаются из-за симптомов астмы как минимум 1 раз в неделю и 39% пациентов просыпаются каждую ночь. Пролонгированные теофиллины и оральные медленно высвобождающиеся
b
2 -агонисты способны уменьшить бронхиальную обструкцию в ночное время, однако не улучшают качество сна.
Результаты исследования M.Kraft и соавт. показали, что терапия сальметеролом 100 мкг 2 раза в день в течение 6 нед уменьшала число ночных пробуждений больных БА (0,9 + 0,1 против 0,4 + 0,1 в группе плацебо), кроме того, число ночей с пробуждениями достоверно снизилось (до 30,6% при терапии сальметеролом и до 69,8% при назначении плацебо). Исследования С.Brambilla и соавт., М.Fitzpatrick и соавт. также продемонстрировали способность сальметерола снижать число ночных пробуждений и улучшать ранние утренние показатели ПОС у больных БА, более того, сальметерол улучшал архитектуру сна у больных БА, приводя к удлинению 4-й стадии сна.
Пролонгированные
b
2
-агонисты при астме физического усилия
Физическое усилие является важным триггером БА, особенно у детей и подростков. Препаратами выбора для профилактики астмы физического усилия (постнагрузочного бронхоспазма) являются
b
2 -агонисты. Хотя препараты короткого действия (например, сальбутамол) способны обеспечить эффективную защиту от развития бронхоспазма или уменьшить его выраженность, продолжительность протективного действия сальбутамола не превышает 2 ч. Пролонгированные препараты сальметерол и формотерол обладают протективным эффектом, не уступающим сальбутамолу, однако продолжительность данного эффекта достигает 12 ч, что позволяет рекомендовать использование пролонгированных
b
2 -агонистов в утреннее время для профилактики астмы физического усилия в течение всего дня.
Длительный протективный эффект пролонгированных симпатомиметиков был доказан в двойном слепом рандомизированном контролируемом исследовании J.Kemp и соавт., сравнивавших влияние сальметерола, сальбутамола и плацебо на симптомы астмы физического усилия у 161 больных БА. В ходе исследования всем больным однократно утром назначался один из препаратов, а затем 3 раза в день с интервалом 6 ч проводили тест с интенсивной физической нагрузкой. Плацебо не оказало никакого протективного влияния, сальбутамол обеспечивал защиту лишь против первой нагрузки, в то время как сальметерол предупреждал развитие бронхоспазма после всех трех нагрузочных тестов.
Однако все данные об эффективности пролонгированных препаратов при астме физического усилия получены в кратковременных исследованиях. Более продолжительные наблюдения показывают, что протективный эффект
b
2 -агонистов длительного действия может полностью ослабевать уже к концу 4-й недели регулярной терапии, что было показано при монотерапии сальметеролом больных с астмой физического усилия. Таким образом, пролонгированные
b
2 -агонисты при астме физического усилия могут быть рекомендованы только для эпизодического использования.
Сочетание пролонгированных
b
2
-агонистов и ИКС
В настоящее время доказано, что наиболее эффективными препаратами для контроля БА являются ИКС. ИКС в рекомендуемых дозах хорошо переносятся и считаются безопасными препаратами. Однако с целью снижения потенциала развития побочных реакций для контроля БА необходим подбор минимально возможных эффективных доз ИКС. Часто, когда БА не контролируется назначенными дозами ИКС, возникает вопрос: следует ли повысить дозы ИКС либо добавить другой препарат? Чаще всего таким препаратом являются
b
2 -агонисты длительного действия, пролонгированные теофиллины, антагонисты лейкотриеновых рецепторов. Пролонгированные
b
2 -агонисты в настоящее время считаются более эффективными препаратами для комбинации с ИКС. Научное обоснование такой комбинации вытекает из комплементарных эффектов ИКС и
b
2 -агонистов. Стероиды повышают экспрессию гена
b
2 -рецептора и уменьшают потенциал для развития десентизации рецептора, в то время как
b
2 -агонисты активируют неактивные глюкокортикоидные рецепторы, делая их более чувствительными для стероидзависимой активации.
Большое число исследований сравнивали эффективность комбинации сальметерола с ИКС и ИКС в двойной дозе. В одном из первых исследований, проведенном A.Greening и соавт., у 426 больных БА, не контролировавшейся бекламетазоном в суточных дозах до 400 мкг, на протяжении 6 мес сравнивали два режима терапии: 1000 мкг бекламетазона либо 400 мкг бекламетазона плюс 100 мкг сальметерола. Несмотря на то что оба режима повысили утренние значения ПОС, снизили дневную вариабельность ПОС, уменьшили дневные и ночные симптомы, данные изменения были достоверно лучше у больных, принимавших комбинацию препаратов. Число побочных реакций было одинаковым в обеих группах больных.
Многоцентровое исследование A.Woolcock и соавт. включало 738 больных с более тяжелой БА, имеющих симптомы, несмотря на прием беклометазона 1000 мкг/сут. В течение 6 мес сравнивали три режима терапии: 1) беклометазон 2000 мкг/сут; 2) беклометазон 1000 мкг/сутки и сальметерол 100 мкг/сут; 3) беклометазон 1000 мкг/сут и сальметерол 200 мкг/сут. Улучшение функциональных показателей, уменьшение ночных симптомов и снижение использования по потребности
b
2 -агонистов короткого действия были значительно более выражены в группах больных, принимавших сальметерол. Однако ни в одной из групп терапия не приводила к достоверному снижению бронхиальной гиперреактивности. Оба приведенных исследования показали способность дополнительного приема сальметерола приводить к улучшению клинических симптомов и функциональных показателей, однако влияние такой терапии на количество обострений БА не рассматривалось. Некоторые исследователи высказывали сомнения по поводу рациональности такого подхода, так как существовала опасность, что
b
2 -агонисты длительного действия могут "замаскировать" снижение контроля воспаления БА и привести к развитию более тяжелых обострений БА. Однако последующие исследования не подтвердили "маскирование" воспаления, так как были получены данные даже о снижении числа обострений БА на фоне комбинированной терапии.
Метанализ MIASMA, посвященный изучению сравнения комбинаций сальметерола и ИКС (бекламетазона и флютиказона) с повышенными дозами ИКС, рассматривал влияние режимов терапии на частоту обострения БА. В метанализ было включено 9 исследований длительностью более 12 нед (общее число больных – 3685). Данный анализ показал, что комбинированная терапия по сравнению с удвоенными дозами ИКС приводит к большему улучшению функциональных показателей, достоверному снижению бессимптомных дней и ночей (р < 0,001). Кроме того, у больных, принимавших ИКС и сальметерол, по сравнению с пациентами, принимавшими повышенные дозы ИКС, было выявлено достоверное уменьшение общего числа обострений БА на 2,73% (p = 0,020), а также числа умеренных и тяжелых обострений на 2,42% (p = 0,029).
В крупном многоцентровом FACET, включавшем 852 больных БА, в течение 1 года проводили сравнение эффективности комбинации формотерола и будесонида и удвоенных доз будесонида. Все пациенты были распределены на 4 группы: 1) будесонид в дозе 400 мкг/сут; 2) будесонид в дозе 400 мкг/сут плюс формотерол 24 мкг/сут; 3) будесонид в дозе 800 мкг/сут; 4) будесонид в дозе 800 мкг/сут плюс формотерол 24 мкг/сут. У больных, принимавших комбинацию препаратов, наблюдали более значительное улучшение дневных и ночных симптомов, повышение показателей ОФВ
1 и ПОС. Число тяжелых и легких обострений БА было снижено на фоне приема высокой дозы будесонида на 49 и 37% соответственно, на фоне приема низких доз будесонида и формотерола на 26 и 40% соответственно, однако наибольшее уменьшение обострений наблюдали у больных, принимавших высокие дозы будесонида и формотерол (на 63 и 62%).
Доказательства отсутствия "маскирования" воспаления на фоне приема комбинированной терапии
b
2 -агонистов длительного действия с ИКС, кроме отсутствия повышения числа обострений, были недавно подтверждены данными морфологических исследований. M.Sue-Chu и соавт. в 12-недельном проспективном исследовании показали, что терапия сальметеролом 100 мкг/сут и флютиказоном 400 мкг/сут по сравнению терапией будесонидом в низких дозах (400 мкг/сут) у больных БА приводила к большему снижению активности воспаления дыхательных путей, по данным биопсии бронхов: уменьшение числа тучных клеток в подслизистом слое (p < 0,05) и IL-4 pos-клеток в слизистой бронхов (p < 0,01).
Высокая эффективность при БА комбинированной терапии
b
2 -агонистов длительного действия с ИКС послужили предпосылкой к созданию фиксированных комбинаций препаратов, например, сальметерол/флютиказона пропионат 50/100, 50/250, 50/500 и будесонид/формотерол 160/4,5, 320/9). Проведенные клинические исследования также подтвердили эффективность данных комплексных препаратов по сравнению с монотерапией ИКС или монотерапией пролонгированными
b
2 -агонистами.
Оказывают ли пролонгированные
b
2
-агонисты влияние на летальность больных БА?
В последние годы широко обсуждается связь регулярного приема ингаляционных
b
2 -агонистов и риска неблагоприятных исходов при БА. Исследования, проведенные методом случай-контроль в Новой Зеландии и Канаде, показали, что риск летальных исходов значительно повышен у больных, регулярно принимающих
b
2 -агонисты. Объяснением этого феномена является персистенция воспаления в дыхательных путях и риск развития обострения БА, несмотря на бронхолитический эффект препаратов. Учитывая длительный бронхолитический эффект пролонгированных
b
2 -агонистов и некоторое, с течением времени, ослабление бронхопротективного эффекта препаратов, возникает опасение: не увеличивают ли данные препараты летальность больных БА?
На основе анализа историй болезни 61 000 больных БА, из которых 2,708 получали терапию сальметеролом, S.Lanes и соавт. показали, что терапия пролонгированными симпатомиметиками не приводит к большему риску поступлений больных в отделения неотложной помощи, госпитализаций по поводу обострения БА или поступлению в отделения интенсивной терапии. Другое исследование, проведенное методом случай-контроль в Великобритании, также не выявило влияния сальметерола на развитие околофатальной БА у больных с тяжелой хронической астмой (относительный риск – ОР – 1,42; 95% доверительный интервал – ДИ – 0,49-4,10; p = 0,52). В недавнем обзоре R.Beasley и соавт., посвященном влиянию использования
b
2 -агонистов на летальность и болезненность больных БА, также не было подтверждено, что
b
2 -агонисты длительного действия значительно ухудшают контроль БА либо увеличивают частоту тяжелых обострений. Таким образом, на основе накопленных данных есть основания считать пролонгированные
b
2 -агонисты безопасными препаратами при длительной терапии больных БА.
Показания к приему пролонгированных
b
2
-агонистов
В настоящее время пролонгированные
b
2 -агонисты рекомендуются больным БА, уже принимающих ИКС в низких дозах и все еще имеющих симптомы БА чаще 1 раза в день, ночные симптомы чаще 1 раза в неделю и показатели ПОС или ОФВ
1 < 80% от должных значений. Альтернативным подходом может быть повышение доз ИКС, однако, учитывая более безопасный профиль и высокую эффективность комбинации ИКС и
b
2 -агонистов длительного действия, сочетанная терапия более предпочтительна. Для контроля течения БА рекомендовано двукратное назначение препаратов (сальметерол по 50 мкг или формотерол по 12 мкг), причем только в сочетании с ИКС. Возможно также и эпизодическое (ситуационное) использование препаратов данного класса в таких ситуациях, как
Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Алла Николаевна Цой
Владимир Владимирович Архипов
ММА им. И.М. Сеченова
Александр Григорьевич Чучалин
НИИ пульмонологии МЗ РФ
Выбор источников достоверной информации имеет решающее значение для эффективной медицинской деятельности на всех ее уровнях. Предложенная в начале 90-х годов концепция доказательной медицины подразумевает добросовестное, точное и осмысленное использование лучших результатов клинических исследований для выбора лечения конкретного больного . Подобный подход позволяет снизить уровень врачебных ошибок, облегчить процесс принятия решения для практических врачей, администрации лечебных учреждений и юристов, а также уменьшить расходы на здравоохранение и использовать сэкономленные средства для претворения в жизнь социально ориентированных медицинских проектов .
Прошло почти 10 лет с появления первого международного руководства по диагностике и лечению бронхиальной астмы (БА) – GINA . Имеется опыт создания аналогичных стандартов по лечению БА, ориентированных на условия и особенности отечественной системы здравоохранения . Подобные руководства подновым углом рассматривают вопросы
обучения и самообразования практических специалистов, стимулируют отказ от недостаточно эффективных методов диагностики и лечения, повышая уровень медицинской помощи больным БА.
Стандарты и протоколы по клинической практике предназначены, главным образом, для врачей широкого профиля (терапевты поликлиник и стационаров, врачи скорой помощи) и посвящены наиболее общим вопросам диагностики и лечения. Поэтому для этих руководств характерны строго ограниченный объем теоретических сведений, отсутствие описаний редких форм заболевания и новых экспериментальных методов лечения. Но благодаря этому они выполняют свою основную функцию – предоставляют врачам необходимую и точную информацию, позволяют оптимизировать лечебный процесс и обеспечить высокое качество медицинской помощи в любом из лечебных учреждений.
Первые руководства по клинической практике строились по принципу консенсуса группы специалистов, однако в наши дни этого подхода явно недостаточно. Современный врач нуждается в строго взвешенных рекомендациях, основанных на данных наиболее качественно выполненных клинических исследований. Поэтому применение методов доказательной медицины, на наш взгляд, более перспективно и в дальнейшем обещает стать стандартом при подготовке клинических руководств.
Цель настоящего обзора – ознакомить практических врачей с результатами использования концепции доказательной медицины (ДМ) на примере рекомендаций по лечению больных БА. При этом обоснование каждой из рекомендаций проводится с учетом уровня доказательности – в соответствии с системой, принятой в доказательной медицине.
Уровень доказательности
Удобным механизмом, который позволяет специалисту легко оценить качество клинического исследования и достоверность полученных данных, является предложенная в начале 90-х годов рейтинговая система оценки клинических исследований. Для непосредственной оценки исследования используется понятие “уровень доказательности”. Обычно выделяют от 3
до 7 уровней доказательности , при этом с возрастанием порядкового номера уровня (обозначается римскими цифрами) качество клинического исследования снижается, а результаты представляются менее достоверными или имеют только ориентировочное значение .
К уровню I в ДМ принято относить хорошо разработанные, крупные рандомизированные двойные слепые плацебоконтролируемые исследования. К этому же уровню доказательности принято относить данные, полученные в ходе мета_анализа нескольких рандомизированных контролируемых исследований . Небольшие рандомизированные контролируемые исследования (в том случае, когда получить статистически корректные результаты не удалось изза малого числа больных, включенных в исследование) относят к II уровню доказательности, а исследования “случай–контроль” и когортные исследования – к II или III уровню. Наконец, данные отчетов экспертных групп или консенсусов специалистов принято относить к III или IV уровню .
Медицина доказательств
В зависимости от мнения составителей (национальные общества ДМ, общества специалистов) одно и то же исследование в различных рейтингах может относиться к разным уровням, однако общий порядок распределения исследований практически везде одинаков. Так, в каждом из этих рейтингов первое место принадлежит крупным рандомизированным двойным слепым плацебоконтролируемым исследованиям (как наиболее достоверным источникам информации), а завершается каждый рейтинг мнениями отдельных специалистов и данными крупных руководств по клинической практике.
В системе ДМ отдельные практические рекомендации по диагностике и лечению различных заболеваний также имеют свой рейтинг – степень убедительности рекомендаций (обозначается латинскими буквами). Рейтинг (уровень) рекомендаций в англоязычной литературе трактуется как сила рекомендаций (Strength of recommendation). При этом уровень рекомендаций, вытекающих из исследований I уровня, обозначается как А, II уровня – В и т.д. Кроме того, к рекомендациям уровня В относятся экстраполяции исследований I уровня доказательности, а рекомендации уровня С строятся как на основании исследований III уровня, так и на экстраполяциях исследований I и II уровней.
Таким образом, рекомендации уровня А представляются вполне убедительными, так как опираются на веские доказательства, у рекомендаций уровня В убедительность относительная, а для рекомендаций уровня С имеющихся доказательств недостаточно, но и эти рекомендации могут использоваться с учетом определенных обстоятельств. Положения, относимые к уровням D и E, представляются недостаточно доказанными .
В настоящем обзоре была принята система оценки клинических исследований, предложенная канадскими специалистами . При присвоении отдельным рекомендациям того или иного рейтингового уровня авторы также опирались на мнение экспертов Великобритании и Канады .
Общие принципы лечения БА в амбулаторных условиях
БА характеризуется значительной вариабельностью тяжести своего течения. Поэтому для терапии БА в конце 80-х годов был предложен ступенчатый терапевтический подход, согласно которому каждой степени тяжести течения заболевания соответствует определенная схема лечения (рис. 1) .
Первоначально было принято выделять 4 степени тяжести БА , но впоследствии показалось рациональным выделить группу больных с очень тяжелым течением БА, у кого адекватный контроль достигается только при применении пероральных глюкокортикостероидов (ГКС) . К этой группе относят также пациентов с “трудной (тяжелой) астмой” (аспириновый вариант БА, ГКС_зависимая и ГКС-резистентная астма, лабильная астма) . Общий алгоритм лечения БА приводится на рис. 2. Он включает диагностический этап, выбор схемы первоначального лечения, подбор долговременной терапии заболевания и последующее наблюдение за больным. Так как БА является хроническим воспалительным заболеванием дыхательных путей , эффективность терапии оценивается не как полное излечение, а как адекватный контроль за течением заболевания, предотвращающий обострения (таблица) .
Рис. 1. Ступенчатый подход к лечению БА.
Признаки контролируемости течения БА
Рис. 2. Алгоритм лечения БА.
Диагностика и клиническая оценка БА
Для подтверждения диагноза БА и оценки тяжести состояния у всех больных с явлениями бронхообструктивного синдрома следует проводить исследование функции внешнего дыхания (С) . Согласно рекомендациям (D), к диагностическим критериям, специфичным для БА, относятся:
– увеличение ОФВ1 > 12% через 15 мин после ингаляции бета2-агониста;
– увеличение ОФВ1 > 20% после 10–14 дней лечения преднизолоном;
– значимая спонтанная вариабельность ОФВ1.
При оценке ОФВ1 и ПСВ следует ориентироваться на среднестатистические нормы для данной популяции, а в идеале – на индивидуальный лучший показатель данного больного, измеренный в период стабильного состояния (С) .
Для установления диагноза БА также можно использовать бронхопровокационный тест с метахолином (С) .
Когда проведение спирометрии или бронхопровокационного теста невозможно, следует оценить вариабельность бронхообструкции при многодневном измерении ПСВ в домашних условиях – вариабельность >20% может указывать на наличие БА (В) .
БА и факторы внешней среды
В целом тяжесть симптомов астмы коррелирует со степенью чувствительности больного к аллергенам , хотя у многих пациентов аллергия не играет ведущей роли в течении заболевания. Следует помнить, что увеличение объема медикаментозной терапии не должно заменять меры по предотвращению контакта больного с аллергенами и ирритантами (С) . Больным БА следует строго воздерживаться от курения (В) и избегать контакта с табачным дымом (С) .
Больным БА следует избегать высокой концентрации ирритантов во вдыхаемом воздухе (С) , но до сих пор не имеется достаточных данных об эффективности применения для этих целей увлажнителей и средств очистки воздуха (С) .
Все взрослые больные с впервые выявленной БА должны проходить обследование для исключения профессионального характера заболевания (В) .
Мониторинг и обучение больных
Обучение пациентов – обязательный компонент лечения астмы (А) . Целью обучения является контроль за течением заболевания и выбор правильного поведения больного в различных ситуациях, связанных с заболеванием. Программа обучения должна строиться не только на ознакомлении больных с соответствующей литературой (А), обучение больных необходимо проводить при каждой встрече медицинских работников с пациентами (В) , что требует хорошего контакта между медицинским работником и обучаемым (С) . Наиболее удобные и информативные средства контроля за эффективностью лечения – наблюдение за функцией внешнего дыхания (спирография и пикфлоуметрия) (А) и определение потребности в бронхолитиках (А) ; это возможно, если пациент ежедневно фиксирует показатели ПСВ и симптомы своего заболевания в виде дневника (А) . Постоянный мониторинг ПСВ может быть полезен у некоторых пациентов, особенно у больных со сниженным восприятием бронхообструкции (С) .
Для улучшения контроля БА для каждого пациента должен составляться письменный индивидуальный план лечения, основанный на самооценке симптомов (В) .
Иммунотерапия
В общем случае проведение иммунотерапии не может быть рекомендовано для лечения БА (В) . Она не должна заменять соблюдение гипоаллергенного режима (С). Целесообразность иммунотерапии может рассматриваться в тех случаях, когда предотвращение контакта с аллергеном и фармакотерапия не приводят к адекватному контролю заболевания (А). Хорошо контролируемая астма не является противопоказанием к проведению иммунотерапии по поводу аллергического риноконъюнктивита и гиперчувствительности к яду насекомых (С) .
Ингаляционные ГКС
Ингаляционные ГКС (ИГКС) эффективны при лечении БА (А) и способствуют сокращению применения системных ГКС у больных с ГКС_зависимым течением БА (А) . Назначение ИГКС больным БА позволяет увеличить величину ПСВ и уменьшить потребность в бронхолитиках (А) .
Лучший уровень контроля за течением БА быстрее достигается при использовании более высоких доз ИГКС (А) . Позднее начало лечения ИГКС в последующем иногда приводит к более низким результатам функциональных тестов (С) .
Все ИГКС в эквивалентных дозах обладают одинаковой эффективностью (А) . Доказана высокая эффективность ИГКС при назначении 2 раза в день; при применении ИГКС 4 раза в день в той же суточной дозе эффективность лечения возрастает незначительно (А) .
ИГКС следует рекомендовать тем больным, у которых обычная потребность в применении бета2-агонистов короткого действия составляет 2–3 приема в день и больше (А) . Первоначальная дневная доза ИГКС обычно должна составлять 400–1000 мкг (в пересчете на беклометазон), при более тяжелом течении БА можно рекомендовать более высокие дозы ИГКС или начать лечение системными ГКС (С) . Стандартные дозы ИГКС (эквивалентные 800 мкг беклометазона) при неэффективности могут быть увеличены до 2000 мкг в пересчете на беклометазон (А) .
Если при лечении ИГКС достигнут положительный результат, дозу ИГКС следует постепенно снижать до минимальной, обеспечивающей контроль за проявлениями астмы (С) . Снижение доз ИГКС следует осуществлять постепенно, уменьшая дозу на 25–50% от исходной после того, как состояние больного оставалось устойчивым в течение 3 мес (С) .
При обострениях БА следует увеличить дозу ИГКС в 2–4 раза (D) или назначить преднизолон в дозе 0,5–1,0 мг/кг/сут (А) , повышенная доза ГКС должна поддерживаться в течение 10–14 дней (С) .
Существенные опасения больных вызывает безопасность применения ГКС. Между тем, ИГКС в низких и средних дозах сравнительно редко вызывают клинически значимые нежелательные эффекты и обладают очень хорошим (т.е. низким) отношением риск/польза (А) .
Пациенты с отягощенной по глаукоме наследственностью или с повышением внутриглазного давления через 5 дней регулярного приема ИГКС должны пройти обследование у окулиста, которое в дальнейшем следует регулярно повторять (D) . Взрослым пациентам, получающим более 1000 мкг/сут ГКС в пересчете на беклометазон, показано проведение денситометрии в случае, если у них имеются факторы риска развития остеопороза (С) .
Больные, регулярно принимающие ИГКС, должны после ингаляций полоскать полость рта водой для предотвращения системной абсорбции препарата (А) . Применение спейсера также снижает риск нежелательного действия ИГКС (D) .
Бета2-агонисты короткого действия
Бета2-агонисты короткого действия являются наиболее эффективными бронхолитическими средствами для купирования симптомов БА (А) и профилактики так называемой астмы физического усилия (А) . Хотя применение Бета2-агонистов короткого действия приводит к эффективному увеличению ПСВ (А) , эти препараты не должны рекомендоваться для постоянного применения в качестве базисной терапии (А) . Наличие у больного потребности в ежедневном применении Бета2-агонистов является показанием к назначению противовоспалительной терапии (А) .
Если у больного бронхоспазм провоцируется физической нагрузкой, то до выполнения физических упражнений рекомендуется применять.2_агонисты короткого действия (А) : например, сальбутамол более эффективен для предотвращения бронхоспазма, вызванного физической нагрузкой, чем кромогликат натрия (А) .
Пероральные бронхолитики следует рассматривать как препараты второго ряда после ингаляционных бронхолитиков (С) .
Бета2-агонисты длительного действия
Применение Бета2-агонистов длительного действия является альтернативой увеличению доз ИГКС при недостаточном контроле за течением БА ; они могут применяться в качестве дополнительной терапии при умеренном и тяжелом течении астмы (А) . Не рекомендуется применять Бета2-агонисты длительного действия для купирования острых приступов БА (кроме формотерола) и применять их без противовоспалительной терапии (В). На фоне применения Бета2-агонистов длительного действия должен быть продолжен прием препаратов короткого действия для купирования симптомов БА (В) .
У большинства больных, получавших сальметерол, удавалось достигнуть удовлетворительного контроля за течением БА при назначении сальметерола по 50 мкг дважды в сутки (В) . Сальметерол вызывает значимую бронходилатацию в течение 12 ч; при назначении препарата в суточной дозе 100 мкг побочные эффекты несущественны, но при увеличении дозы их риск увеличивается (В) . Применение сальметерола 2 раза в день более эффективно, чем использование препаратов короткого действия 4 раза в день (А) . Назначение сальметерола у больных с недостаточным контролем за течением БА может быть столь же эффективно, как увеличение дозы ИГКС в 2 раза .
Антагонисты лейкотриеновых рецепторов
Антагонисты лейкотриеновых рецепторов (АЛ) являются альтернативой увеличению доз ИГКС при недостаточном контроле за течением астмы; АЛ могут применяться совместно со средними и высокими дозами ИГКС (А) . Недостаточно данных, которые позволили бы отнести АЛ к числу противовоспалительных препаратов первого выбора у больных БА, однако у пациентов, которые не могут принимать ГКС, АЛ являются препаратами выбора (D) . Другое показание к применению АЛ – аспириновый вариант БА (D) .
Дополнительная терапия
Кромогликат натрия и недокромил можно применять в качестве альтернативы Бета2-агонистам для предотвращения астмы физического усилия (А) . Не существует свидетельств, на основании которых можно предпочесть недокромил кромогликату натрия или наоборот (А) . Хотя недокромил более эффективен, чем плацебо, однако степень его эффективности не позволяет рекомендовать препарат в качестве средства первого ряда при БА (А). Тем не менее, у детей младше 12 лет и у взрослых с легким течением БА он может являться альтернативой низким дозам ИГКС, не обладая нежелательными эффектами ГКС (А). Теофиллин не должен применяться при БА в качестве препарата первого ряда (А) . У пациентов с течением БА, при котором средние дозы ИГКС неэффективны, добавление теофиллина к лечению может улучшить контроль за течением БА и сократить потребность в ГКС (В) . Дозу теофиллина следует увеличивать постепенно путем титрования (С) .
Средства доставки
При лечении БА ингаляционный путь доставки бронхолитиков и противовоспалительных препаратов является более предпочтительным, чем назначение этих лекарственных средств перорально или парентерально (А) . В последние годы существенно расширился арсенал средств доставки ингаляционных препаратов. Условно принято выделять дозированные аэрозольные ингаляторы (ДАИ) (применяются со спейсером или без него), порошковые ингаляторы (турбухалер, дискхалер, циклохалер и т.п.) и небулайзеры. Существует алгоритм подбора больному адекватного средства доставки (С) . Согласно этому алгоритму, первоначально больным БА следует назначать лекарства в виде ДАИ. Если при употреблении ДАИ у больного возникают трудности, следует дополнительно применять спейсер большого объема (>0,75 л). Если же и при применении ДАИ со спейсером больной не справляется с техникой ингаляций или не может применять их в течение всего дня, то ему показано назначение препарата в виде порошкового ингалятора или ДАИ, активируемого вдохом (например, ДАИ “легкое дыхание”).
ДАИ со спейсером показан для всех возрастных групп, у пожилых больных и детей можно применять ДАИ со спейсером, оснащенным лицевой маской (В). При применении любой системы доставки ингаляционных препаратов необходимо периодически оценивать технику ингаляции и проводить обучение больных (А) .
Применение ИГКС через спейсер позволяет уменьшить риск кандидоза полости рта (А) . При обострении БА применение спейсера большого объема является эффективной альтернативой применению небулайзера, при этом удается в несколько (до 7–14) раз уменьшить дозы бронхолитических средств (А) . Применение ДАИ со спейсером большого объема (>0,75 л) можно рекомендовать и при тяжелых обострениях астмы (А) . ДАИ и порошковые ингаляторыодинаково эффективны (А) .
Лечение БА в стационаре
Признаком нестабильного течения БА на всех ее стадиях является увеличение потребности в ингаляционных Бета2-агонистах (С), более частое, чем обычно, появление симптомов бронхообструкции и уменьшение величины ПСВ (А) .
Пациенты, у которых величины ОФВ1 и ПСВ, измеренные до начала лечения, меньше 40% от индивидуального лучшего показателя или меньше должных величин (ПСВ < 100 л/мин или ОФВ1 < 1 л), нуждаются в госпитализации в стационар (А) . Величины ОФВ1 и ПСВ меньше 40% от индивидуального лучшего показателя, гиперкапния, отсутствие ответа на лечение, отрицательная динамика состояния служат показаниями для лечения в условиях отделения интенсивной терапии (D) .
Купирование обострения БА в условиях отделения интенсивной терапии
Кислородотерапия показана больным с обострением БА и должна проводиться до тех пор, пока уровень сатурации не превысит 94% (D). Измерение газов артериальной крови показано больным в критическом состоянии, признаками гиперкапнии и при снижении сатурации менее 90% (D) .
Бета2-агонисты короткого действия относятся к препаратам первого ряда для лечения обострений БА. Эти препараты назначаются в виде ингаляций, а титрование дозы производится с учетом объективных и клинических признаков бронхообструкции (А). Внутривенно Бета2-агонисты не должны применяться вместо ингаляций при лечении обострения БА (А), так как ингаляции сальбутамола более эффективны, чем его внутривенное назначение (А) . Парентерально бронхолитики можно применять в тех случаях обострений БА, когда назначение ингаляционных средств проблематично (например, при выраженном кашле) (С) .
Выбор средства доставки (ДАИ, спейсер, небулайзер) зависит от характера проводимой терапии, доступности этих устройств и индивидуальных особенностей пациента (А). Применение ДАИ со спейсером большого объема более предпочтительно, чем использование небулайзера, независимо от возраста и тяжести состояния больного (А) .
Все больные с обострением БА, поступившие в стационар по скорой медицинской помощи, должны получать системные ГКС (А) . ГКС при внутривенном и пероральном введении при тяжелом обострении БА демонстрируют одинаковую эффективность (А), поэтому при обострениях БА следует использовать пероральные ГКС (А) .
Преднизолон назначается перорально в дозе 30–60 мг ежедневно до тех пор, пока не купируется обострение и течение БА не становится контролируемым, а показатели функции внешнего дыхания не возвращаются к исходным. Обычно достаточно применение преднизолона в течение 7–14 дней, хотя лечение может быть продолжено до 3 нед (С) . При этом надо помнить о возможности кровотечения из желудочно-кишечного тракта, причем риск такого кровотечения повышен у больных, уже имевших в анамнезе кровотечения или применяющих антикоагулянты (С) . Если продолжительность лечения пероральными ГКС не превышала 2 нед, отменять их прием следует одномоментно (С) .
Применение холинолитиков в сочетании с бета2-агонистами можно рекомендовать при обострениях БА средней тяжести, они также могут оказаться эффективными и при тяжелых обострениях БА (А) .
Применение теофиллина не показано в первые 4 ч пребывания пациента в стационаре (А) .
При резистентных к лечению обострениях БА можно применять адреналин (внутримышечно и внутривенно) (В) , сальбутамол (внутривенно), магний (внутривенно) (А), гелиокс (С) . При экстренной интубации следует применять кетамин и сукцинилхолин (А) .
Лечение обострения БА в условиях стационара
В дополнение к терапии системными ГКС всем пациентам с обострением БА, поступившим в стационар по скорой медицинской помощи, показано назначение ИГКС (D) . Бета2-агонисты короткого действия должны назначаться в ингаляционной форме, выбор средства доставки (ДАИ, спейсер, небулайзер) зависит от характера проводимой терапии, доступности этих устройств и индивидуальных особенностей пациента (А) .
Применение ДАИ со спейсером большого объема предпочтительнее, чем использование небулайзера, благодаря быстрому ответу на лечение, простоте титрования дозы и более эффективному использованию труда медицинского персонала (А) .
Холинолитики можно применять в сочетании с.2_агонистами в течение 24–48 ч при тяжелых обострениях БА и, возможно, при обострениях средней тяжести (А) .
Оценка ответа на лечение и критерии выписки пациента из стационара должны базироваться на результатах исследования функции внешнего дыхания в динамике и на уровне контроля за симптомами БА (С) . Обучение пациента, включая составление индивидуального плана лечения, должно происходить уже в период госпитализации (А) .
После выписки из стационара пациенты должны продолжить прием системных ГКС (30–60 мг/сут), так, чтобы общая продолжительность приема системных ГКС составила 14–21 день (А) .
Пациенты, у которых уровень ОФВ1 достиг или превысил 70% от должного, имеющие доступ к необходимым медикаментам, овладевшие адекватной техникой ингаляции и получившие индивидуальный лечебный план, могут быть выписаны из стационара (D) .
Cписок литературы
1. Бронхиальная астма, глобальная стратегия // Пульмонология. 1996. Прил. 1. С. 1.
2. Доказательная медицина // Клиническая фармакология. 1999. Т. 6. С. 3.
3. Основные положения отчета группы экспертов ЕPR-2: ведущие направления в диагностике и лечении бронхиальной астмы / Пер. под ред. Цой А.Н. М., 1998.
4. Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями легких / Под ред. Чучалина А.Г. М., 1999.
5. Цой А.Н., Архипов В.В. // Рус. мед. журн. 2001. Т. 9. С. 4. 6. Barnes P.J. et al. // Am. J. Respir. Crit. Care Med. 1998. V. 157. P. 51.
7. Beveridge R.C. et al. // Can. Med. Association J. 1996. V. 155. P. 25.
8. Canаdian asthma consensus report, 1999 // Can. Med. Association J. 1999. V. 161. Suppl. 11.
9. Casavant M.G. et al. // Annals of Emergency Medicine. 2000. V. 35. P. 47.
10. Difficult/therapy_resistant asthma // Eur. Respir. J. 1999. V. 13. P. 1198.
11. Eccles M. et al. // BMJ. 1996. V. 312. P. 760.
12. Emond S.D. et al. // Annals of Emergency Medicine. 1998. V. 31. P. 590.
13. Greening A.P. et al. // Lancet. 1994. V. 344. P. 219.
15. Koury T. G. et al. // Am. J. of Emergency Medicine. 1998. V. 16. P. 572.
16. Levy B.D. et al. // Int. Care Med. 1998. V. 24. P. 105.
17. Lin R. Y. et al. // Am. J. of Emergency Medicine. 1997. V. 15. P. 621.
18. Lipworth B. // Lancet. 1997. V. 350. Suppl. II. P. 18.
19. North of England evidence based guidelines development project // BMJ. 1996. V. 312. P. 762.
20. O’Donohue W.J. // Chest. 1996. V. 109. P. 814.
21. Raimondi A.C. et al. // Chest. 1997. V. 112. P. 24.
22. Rodrigo C., Rodrigo G. // Chest. 1998. V. 113. P. 593.
23. Shrewsbury S. et al. // BMJ. 2000. V. 320. P. 1368.
24. Swedish Society of Chest Medicine // Eur. Respir. J. 1990. V. 3. P. 163.
25. The British Guidelines on Asthma Management: 1995 review and position statement // Thorax. 1997. V. 52. Suppl. I. P. 1.
986 0
Лечение больных бронхиальной астмой (БА) является комплексным, оно включает медикаментозное и немедикаментозное лечение с соблюдением противоаллергического режима.
Для медикаментозного лечения заболевания применяются два вида лекарственных препаратов: препараты для оказания экстренной помощи и профилактические препараты для длительного контроля БА.
Препараты для оказания экстренной помощи
в 2 -агонисты короткого действия - сальбутамол, фенотерол, тербуталин - вызывают расслабление гладкой мускулатуры бронхов, усиление мукоцилиарного клиренса, снижение сосудистой проницаемости. Предпочтительным способом введения этих препаратов является ингаляционный. Для этого в 2 -агонисты выпускаются в виде дозированных аэрозолей, порошковых ингаляторов и растворов для небулизации. При необходимости введения больших доз используются ингаляции сальбутамола или фенотерола через небулайзер.Антихолинергические препараты (ипратропиума бромид) - менее мощные бронходилататоры, чем в 2 -агонисты, и, как правило, начинают действовать позже. Следует отметить, что ипратропиума бромид усиливает действие в 2 -агонистов при их совместном применении (фиксированная комбинация с фенотеролом - беродуал). Способ введения ингаляционный.
Системные глюкокортикостероиды (ГКС) (преднизолон, метилпреднизолон, триамцинолон, дексаметазон, бетаметазон). Способ введения парентеральный или пероральный. Предпочтение отдается пероральной терапии.
Теофиллины короткого действия - бронходилататоры, которые в целом менее эффективны, чем ингаляционные в-адреностимуляторы (АдС) . Теофиллин обладает значительными побочными действиями, которых можно избежать, правильно дозируя препарат и проводя мониторинг его концентрации в плазме крови. Если больной получает препараты с медленным высвобождением теофиллина, определение концентрации теофиллина в плазме перед его назначением является обязательным.
Профилактические препараты для длительного контроля бронхиальной астмы
Ингаляционные ГКС (беклометазона дипропионат, будесонид, флунизолид, флютиказона пропионат, триамцинолона ацетонид). Применяются как противовоспалительные средства для контроля течения бронхиальной астмы на протяжении длительного времени. Дозы определяются степенью тяжести БА. Лечение ингаляционными ГКС назначают через спейсер, что способствует более эффективному контролю БА и уменьшает некоторые побочные действия.Кромоны (кромогликат натрия и недокромил) - ингаляционные противовоспалительные препараты нестероидной структуры для длительного контроля бронхиальной астмы. Эффективны для предотвращения бронхоспазма, спровоцированного аллергенами, физической нагрузкой и холодным воздухом.
В 2 -агонисты длительного действия (сальметерол, формотерол, сальтос). Особенно эффективны для предупреждения ночных приступов удушья. Применяют в сочетании с противовоспалительными базисными препаратами. Способы применения - пероральный или ингаляционный.
Теофиллины пролонгированного действия
Способ применения пероральный. Благодаря пролонгированному действию уменьшается частота ночных приступов, замедляются ранняя и поздняя фазы аллергической реакции. Необходимо мониторировать содержание теофиллина в плазме, чтобы избежать передозировки с серьезными осложнениями.Антагонисты лейкотриеновых рецепторов (зафирлукаст, монтелукаст) - новая группа противовоспалительных противоастматических препаратов. Способ применения - пероральный. Препараты улучшают функцию внешнего дыхания (ФВД) , уменьшают потребность в в 2 -агонистах короткого действия, эффективны для предотвращения бронхоспазма, спровоцированного аллергенами, физической нагрузкой.
Системные ГКС применяют при тяжелом течении БА. Их следует назначать в минимальной дозе для ежедневного приема или, если возможно, то применять через день.
Комбинированные препараты
Несмотря на то, что ингаляционные ГКС являются основой терапии БА, они не всегда позволяют полностью контролировать воспалительный процесс в бронхиальном дереве и, соответственно, проявления бронхиальной астмы. В связи с этим возникала необходимость в добавлении к ингаляционным ГКС длительнодействующих АдС.На фармацевтическом рынке они представлены двумя препаратами: формотеролом и сальметеролом. Добавление в 2 -агонистов длительного действия рекомендуется при недостаточном контроле БА монотерапией ингаляционными ГКС (начиная со ступени 2). В ряде исследований было показано, что комбинация ингаляционных ГКС с в 2 -агонистами длительного действия более эффективна, чем удвоение дозы ингаляционных ГКС, и приводит к лучшему контролю над симптомами БА и более значимому улучшению функции легких.
Было показано также снижение количества обострений и улучшение качества жизни у пациентов, получающих комбинированную терапию. Таким образом, создание комбинированных препаратов, составными компонентами которых являются ингаляционные ГКС и в 2 -агонисты длительного действия, стало следствием эволюции взглядов на терапию бронхиальной астмы.
Как было сказано выше, в настоящее время из комбинированных препаратов применяют серетид и симбикорт.
Ступенчатый подход к терапии
При лечении БА в настоящее время применяют ступенчатый подход, при котором интенсивность терапии возрастает по мере увеличения степени тяжести БА (наименьшая тяжесть соответствует ступени 1, а наибольшая - ступени 4). Схемы ступенчатой терапии бронхиальной астмы у взрослых представлены в таблице 5.| Степень тяжести |
Препараты базисной
терапии |
Другие варианты
терапии |
|
Ступень 1 Интермиттирующая БА |
Курсовое лечение не требуется |
|
|
Ступень 2 Легкая персистирующая БА |
ингаляционные глюкокортикостероиды (ИГКС) ( |
Теофиллины медленного высвобождения или Кромоны или Антагонисты лейкотриенов |
|
Ступень 3 Персистирующая БА средней тяжести |
ИГКС (200-1000 мкг беклометазона дипропионата или эквивалентные дозы других ИГКС) + ингаляционные в 2 -агонисты длительного действия |
ИГКС (500-1000 мкг беклометазона дипропионата или эквивалентные дозы других ИГКС) + теофиллины медленного высвобождения или ИГКС (500-1000 мкг беклометазона дипропионата или эквивалентные дозы других ИГКС) + пероральные в 2 -агонисты длительного действия или ИГКС в более высокой дозе (>1000 мкг беклометазона дипропионата или эквивалентные дозы других ИГКС) или ИГКС (500-1000 мкг беклометазона дипропионата или эквивалентные дозы других ИГКС) + антагонисты лейкотриенов |
|
Ступень 4 Тяжелая персистирующая БА |
ИГКС (>1000 мкг беклометазона дипропионата или эквивалентные дозы других ИГКС) + ингаляционные в 2 -агонисты длительного действия + при необходимости, один или несколько из ниже перечисленных средств: - теофиллины медленного высвобождения - антагонисты лейкотриенов - пероральные в 2 -агонисты длительного действия - пероральные глюкокортикоиды |
Примечание: На любой ступени, если контроль над бронхиальной астмой достигнут и сохраняется, по меньшей мере, 3 месяца, следует предпринять попытку ступенчатого уменьшения объема поддерживающей терапии для определения минимального объема терапии, необходимого для контролирования заболевания. На любой ступени в дополнение к базисной терапии назначают ингаляционные в 2 -агонисты короткого действия по потребности для облегчения симптомов, но не более 3-4 раз в день.
Целью ступенчатой терапии является достижение контроля БА с применением наименьшего количества лекарственных препаратов. Количество, частота приема и дозировка лекарств увеличиваются (ступень вверх), если течение бронхиальной астмы ухудшается, и уменьшаются (ступень вниз), если течение БА хорошо контролируется. На каждой ступени необходимо избегать воздействия триггерных факторов или контролировать их.
Ступень 1. Интермиттирующее (эпизодическое) течение БА. Длительная терапия противовоспалительными препаратами, как правило, не показана.
Лечение включает профилактический прием лекарств перед физической нагрузкой, контактом с аллергеном или другим провоцирующим фактором (ингаляционные в 2 -агонисты, кромогликат или недокромил). Как альтернатива ингаляционным в 2 -агонистам короткого действия могут быть предложены антихолинергические препараты, пероральные в 2 -агонисты короткого действия или теофиллины короткого действия, хотя у этих препаратов более позднее начало действия и/или выше риск развития побочных эффектов.
Ступень 2. Легкое персистирующее течение бронхиальной астмы. Больные с легким персистирующим течением БА нуждаются в ежедневном длительном профилактическом приеме лекарств: ингаляционных ГКС 200-500 мкг/сут или кромогликата натрия или недокромила в стандартных дозах.
Если симптомы персистируют, несмотря на начальную дозу ингаляционных ГКС, и врач уверен в том, что больной правильно использует препараты, дозу ингаляционных глюкокортикостероидов следует увеличить от 400-500 до 750-800 мкг/сут беклометазона дипропионата или эквивалентной дозы другого ингаляционного ГКС. Возможная альтернатива увеличению дозы ингаляционных ГКС, особенно для контроля ночных симптомов - добавление к дозе ингаляционных ГКС не меньше чем 50 мкг в 2 -агонистов длительного действия (формотерол, сальметерол) на ночь.
Если контроля бронхиальной астмы не удается достичь, что выражается более частыми симптомами, увеличением потребности в бронходилататорах короткого действия или падением показателей ПСВ, то следует перейти на ступень 3.
Ступень 3. Среднетяжелое течение БА. Больные со средней тяжестью течения БА требуют ежедневного приема профилактических противовоспалительных препаратов для установления и поддержания контроля над бронхиальной астмой. Доза ингаляционных ГКС должна быть на уровне 800-2000 мкг беклометазона дипропионата или эквивалентной дозы другого ингаляционного ГКС.
Бронходилататоры длительного действия могут быть также назначены в дополнение к ингаляционным ГКС, особенно для контроля ночных симптомов (можно применять теофиллины и в 2 -агонисты длительного действия). Купировать симптомы следует в 2 -агонистами короткого действия или альтернативными препаратами. При более тяжелых обострениях следует провести курс лечения пероральными ГКС.
Если контроля БА не удается достичь, что выражается более частыми симптомами, увеличением потребности в бронходилататорах или падением пиковой скорости выдоха (ПСВ) , то следует перейти на 4 ступень.
Ступень 4. Тяжелое течение БА. У больных с тяжелым течением бронхиальной астмы полностью контролировать БА не удается. Целью лечения становится достижение лучших возможных результатов: минимального количества симптомов, минимальной потребности в в 2 -агонистах короткого действия, лучших возможных показателей ПСВ, минимального разброса ПСВ и минимальных побочных эффектов от приема препаратов. Лечение обычно проводят с помощью большого количества контролирующих течение БА препаратов.
Первичное лечение включает ингаляционные ГКС в высоких дозах (800-2000 мкг/сут беклометазона дипропионата или эквивалентные дозы других ингаляционных ГКС). К ингаляционным ГКС рекомендуется добавить пролонгированные бронходилататоры. Можно применять антихолинергический препарат (ипратропиума бромид), особенно у больных, которые отмечают побочные явления от в 2 -агонистов.
Ингаляционные в 2 -агонисты короткого действия можно использовать, при необходимости, для облегчения симптомов, но частота их приема не должна превышать 3-4 раз в сутки. Более тяжелое обострение может потребовать проведения курса пероральных ГКС.
Методы оптимизации противоастматической терапии
Методы оптимизации противоастматической терапии можно описать в виде блоков следующим образом.Блок 1. Первый визит пациента к врачу, оценка степени тяжести, определение тактики ведения больного. Если состояние больного требует экстренной помощи, то лучше его госпитализировать. При первом визите точно установить степень тяжести сложно, так как для этого необходимо знать колебания ПСВ и выраженности клинических симптомов в течение недели. Обязательно следует учитывать объем проводимой терапии до первого визита к врачу. Следует продолжить уже назначенную терапию на период мониторирования. При необходимости, можно рекомендовать дополнительный прием АдС короткого действия.
Если больному предположительно БА легкой или средней степени тяжести не требуется экстренного назначения терапии в полном объеме, то назначается вводный недельный период мониторирования. В противном случае необходимо проводить адекватное лечение и мониторировать больного в течение 2 недель. Пациент заполняет дневник клинических симптомов и регистрирует показатели ПСВ в вечерние и утренние часы.
Блок 2. Определение степени тяжести БА и выбор соответствующего лечения проводят на основании классификации бронхиальной астмы по степени тяжести. Предусматривается визит к врачу через неделю после первого визита, если не назначена терапия в полном объеме.
Блок 3. Двухнедельный период мониторирования на фоне проводимой терапии. Пациент заполняет дневник клинических симптомов и регистрирует показатели ПСВ.
Блок 4. Оценка эффективности терапии. Визит через 2 недели на фоне проводимой терапии.
Ступень вверх. Увеличить объем терапии следует, если контроля БА не удается достичь. Однако при этом следует оценить, правильно ли больной принимает лекарства соответствующей ступени и нет ли контакта с аллергенами или другими провоцирующими факторами.
Контроль бронхиальной астмы считается неудовлетворительным, если у больного:
Эпизоды кашля, свистящего или затрудненного дыхания возникают более 3 раз в неделю;
- симптомы появляются ночью или в ранние утренние часы;
- увеличивается потребность в использовании бронходилататоров короткого действия;
- увеличивается разброс показателей ПСВ.
Ступень вниз. Снижение поддерживающей терапии возможно, если БА остается под контролем не менее 3 месяцев. Это помогает снизить риск побочного действия и повышает восприимчивость больного к планируемому лечению. Уменьшать терапию следует ступенчато, постепенно понижая дозу или отменяя дополнительные препараты. Необходимо наблюдать за симптомами, клиническими проявлениями и показателями ФВД.
Таким образом, хотя БА - заболевание неизлечимое, вполне уместно ожидать, что у большинства больных может и должен быть достигнут контроль над течением заболевания.
Важно также отметить, что подход к диагностике, классификации и лечению бронхиальной астмы с учетом тяжести ее течения позволяет создавать гибкие планы лечения и специальные лечебные программы в зависимости от доступности противоастматических препаратов, системы регионального здравоохранения и особенностей конкретного больного.
Следует еще раз напомнить, что одно из центральных мест в лечении БА в настоящее время занимает образовательная программа для больных и диспансерное наблюдение.
Саперов В.Н., Андреева И.И., Мусалимова Г.Г.
Средства, стимулирующие отхаркивание
Рефлекторно действующие препараты
К ним относят препараты термопсиса, истода, алтея, солодки, мать-и-мачехи. При приеме внутрь препараты этой группы оказывают умеренное раздражающее действие на рецепторы желудка, что рефлекторно усиливает секрецию слюнных желез и слизистых желез бронхов. Действие этих препаратов непродолжительно, поэтому необходимы частые приемы малых доз (каждые 2-4 часа). Из отхаркивающих средств назначают обильное щелочное питье, настои и отвары алтея, термопсиса — до 10 раз в день. Отхаркивающие средства применяют как в период обострения заболевания, так и в период ремиссии.
Препараты резорбтивного действия: йодид натрия и калия, гидрокарбонат натрия и другие солевые препараты. Они увеличивают бронхиальную секрецию, вызывают разжижение бронхиального секрета и тем самым облегчают отхаркивание.
Муколитические препараты
Бромгексин.
Таблетки и драже по 8, 12, 16 мг. Микстура во флаконе.
Сироп. Раствор для перорального применения. Взрослым назначают по 8-16 мг 4 раза в день.
Бисольвон.
Таблетки по 8 мг 100 штук в упаковке. Раствор для перорального применения. Эликсир. Назначают по 8-16 мг 4 раза в день.
Амбробене (амброксол).
Таблетки по 30 мг 20 штук в упаковке. Капсулы ретард по 75 мг по 10 и 20 штук в упаковке. Раствор для перорального применения по 40 и 100 мл во флаконах. Сироп 100 мл во флаконах. Обычная суточная доза препарата в таблетках — 60 мг. Принимают по 1 таблетке 2-3 раза в день с пищей, запивая небольшим количеством жидкости. Капсулы продленного действия (капсулы ретард) назначают по 1 штуке утром. Раствор в течение первых 2-3 дней прописывают по 4 мл 3 раза в сутки, а затем по 2 мл 3 раза в сутки. Препарат в виде сиропа рекомендуют взрослым в первые 2-3 дня по 10 мл 3 раза в день, а затем по 5 мл 3 раза в день.
Лазольван.
Таблетки по 30 мг 50 штук в упаковке. Сироп по 100 мл во флаконах. Назначают по 30 мг 2-3 раза в день.
Существует также большое количество комбинированных препаратов: доктор МОМ, бронхолитин, бронхикум и т. д.
В настоящее время появился препарат, который обладает одновременно противовоспалительным и бронхорасширяющим эффектом. Этот препарат называется эреспал (фенспирид). При лечении эреспалом происходит уменьшение степени обструкции дыхательных путей, снижается количество выделяемой мокроты, что связано как с уменьшением образования, так и с уменьшением выделения секрета, то есть препарат действует в плане уменьшения избыточного образования слизи. Выпускается в таблетках по 80 мг (30 таблеток в упаковке). Препарат назначают по 2-3 таблетки в день.
Аэрозольтерапия фитонцидами и антисептиками может проводиться с помощью ультразвуковых ингаляторов, которые создают однородные аэрозоли с оптимальным размером частиц, проникающие до периферических отделов бронхиального дерева. Использование лекарственных средств в виде аэрозолей обеспечивает их высокую местную концентрацию и равномерное распределение препарата в бронхиальном дереве. С помощью аэрозолей можно ингалировать антисептики фурацилин, риванол, хлорофиллипт, сок лука или чеснока (разводится 0,25%-ным раствором новокаина в соотношении 1:30), настой пихты, конденсат брусничного листа, диоксидин. После аэрозольной терапии проводится постуральный дренаж, вибрационный массаж.
В периоды ремиссии хронического бронхита проводят мероприятия вторичной профилактики, направленные на предупреждение обострений. Наиболее предпочтителен и безопасен ингаляционный путь введения препаратов, который обычно не вызывает серьезных побочных эффектов. При таком способе введения бронхорасширяющий препарат попадает сразу в бронхи. Существует большое разнообразие ингаляторов, а наиболее распространены дозированные.
Для того чтобы обеспечить максимальное попадание лекарственного препарата в глубь дыхательных путей, очень важно правильно пользоваться дозированным ингалятором.
Техника пользования ингалятором следующая:
Встряхнуть ингалятор (чтобы получить однородный по размеру частиц аэрозоль); cнять защитный колпачок (многие пациенты забывают это делать); несколько запрокинуть голову назад (чтобы немного распрямить верхние дыхательные пути и обеспечить свободное поступление лекарства в бронхи); перевернуть ингалятор дном вверх (мундштук должен быть внизу); cделать полный выдох.
Плотно обхватить мундштук ингалятора губами (чтобы не распылять препарат в воздух).
Начиная делать вдох, нажать на дно ингалятора и глубоко вдохнуть лекарство (сделать только одно нажатие на дно баллончика). Задержать дыхание на 5-10 секунд (чтобы лекарство осело на стенку бронхов). Сделать спокойный выдох. При необходимости повторить манипуляцию.
Важно понять, что несмотря на хорошее самочувствие, необходимо проводить регулярное лечение. Связано это с тем, что прогрессирование процесса происходит незаметно, исподволь, в течение многих лет. Поэтому, когда у пациента появляются выраженные изменения самочувствия (одышка при небольшой физической нагрузке и в покое), процесс изменений в бронхах выражен уже значительно. Следовательно, для того чтобы приостановить прогрессирование процесса, необходимо начинать лечиться как можно раньше, то есть непосредственно с момента установления диагноза.
Еще одно положение, на которое хотелось бы обратить внимание, — это то, что лечение хронического обструктивного бронхита — не вопрос временного уменьшения одышки, или эпизодического, курсового лечения каким-либо препаратом. Лечение заболевания — это терапия, проводимая регулярно в течение многих месяцев и лет. Только так можно замедлить темпы прогрессирования заболевания и сохранить удовлетворительное самочувствие и хорошую физическую активность в течение длительного времени.
Так как в развитии и прогрессировании хронического обструктивного бронхита основную роль играет сужение бронхов, то для постоянного лечения заболевания применяют в основном препараты, расширяющие бронхи. Идеальный бронхорасширяющий препарат для лечения хронического обструктивного бронхита должен отвечать следующим требованиям: высокая эффективность; минимальное число и выраженность побочных реакций; сохранение эффективности несмотря на длительное применение.
Этим требованиям на сегодняшний день более всего отвечают ингаляционные холинолитики. Они обладают действием в основном на крупные бронхи. Препараты этой группы характеризуются выраженным бронхорасширяющим действием и минимальным количеством побочных эффектов. К ней относятся атровент, тровентол, трувент.
Эти препараты не вызывают тремора (дрожи), не оказывают воздействия на сердечно-сосудистую систему. Начинают лечение атровентом обычно с 2-х ингаляций 4 раза в сутки. Уменьшение бронхиальной обструкции и, следовательно, улучшение самочувствия наступает не ранее 7-10-го дня после начала терапии. Возможно увеличение дозы препарата до 16-24 вдохов в сутки. Препараты этой группы используются для базисной длительной бронхорасширяющей терапии. Предпочтительно использовать дозированный ингалятор со спейсером.
Атровент.
Дозированный аэрозоль. 300 доз по 20 мкг.
Ингаляционные В-2-Агонисты короткого действия
Также оказывают бронхорасширяющее действие. Эти препараты при хроническом обструктивном бронхите менее эффективны, чем холинолитики. Препараты этой группы рекомендуется использовать не более 3-4 раз в день или в качестве профилактики перед физической нагрузкой. Комбинированное применение ингаляционных бетта-2-агонистов короткого действия у больных хроническим обструктивным бронхитом более эффективно, чем терапия бронхорасширяющими препаратами одной группы.
Необходима осторожность в применении препаратов группы бетта-2-агонистов пожилым людям, особенно при наличии сердечно-сосудистых заболеваний.
Побочные эффекты: возможна дрожь кистей рук, внутренняя дрожь, напряженность, сердцебиение, тошнота, рвота.
Наиболее распространенными препаратами этой группы являются следующие.
Беротек (фенотерол). Дозированный аэрозоль для ингаляций. 300 ингаляционных доз по 200 мкг.
Беротек-100 (фенотерол). (Берингер Ингельхайм, Германия). Дозированный аэрозоль, содержащий более низкую дозу препарата, — 100 мкг.
Сальбутамол.
Дозированный аэрозоль по 100 мкг в одной дозе.
Вентолин (сальбутамол). Аэрозольный ингалятор по 100 мкг в одной дозе.
Существует препарат, представляющий собой комбинацию препаратов этих двух групп.
Беродуал (20 мкг ипратропиума бромида + 50 мкг фенотерола). Два бронхорасширяющих препарата, содержащихся в беродуале, обладают в комбинации более сильным эффектом, чем каждый из них в отдельности. В случае неэффективности комбинированного лечения ингаляционными холинолитиками и бетта-2-агонистами короткого действия врач может порекомендовать вам препараты еще одной группы.
Основным представителем группы метилксантинов является теофиллин. Он оказывает более слабое бронхорасширяющее действие по сравнению с ингаляционными холинолитиками и бета-2-агонистами. Однако, кроме бронхорасширяющего действия, препараты этой группы обладают рядом других свойств: предотвращают или уменьшают утомление дыхательной мускулатуры; активизируют двигательную способность реснитчатого эпителия; стимулируют дыхание.
Побочные эффекты: раздражение слизистой оболочки желудка, боль в эпигастральной области, тошнота, рвота, понос, возбуждение, бессонница, беспокойство, головная боль, дрожь, учащенное сердцебиение, аритмии, снижение артериального давления.
Из препаратов группы теофиллина наибольший интерес представляют его продленные формы.
Существует большое число предлагаемых препаратов этой группы. Назначаются они врачом. Доза и схема лечения зависят от степени тяжести заболевания и некоторых других индивидуальных факторов.
Препараты I поколения (принимаются 2 раза в день)
Теопек.
Таблетки по 0,3 г. 50 штук в упаковке.
Слоу-филлин. Таблетки по 0,1 и 0,2 г. 100 штук в упаковке.
Теотард.
Капсулы-ретард по 0,1, 0,2, 0,3 г. 20, 60 и 100 штук в упаковке.
Дурофиллин.
Капсулы по 0,125 и 0,25 г. 40 штук в упаковке.
Ретафил.
Таблетки по 0,2 и 0,3 г. 100 штук в упаковке.
Препараты II поколения (принимаются 1 раз в день)
Эуфилонг.
Капсулы-ретард по 0,375 и 0,25 г. 20, 50, 100 штук в упаковке.
Еще одной группой препаратов, которую можно посоветовать принимать в качестве базисной терапии, являются глюкокортикостероиды. При хроническом обструктивном бронхите их назначают в тех случаях, когда обструкция дыхательных путей остается тяжелой и обусловливает потерю трудоспособности несмотря на прекращение курения и оптимальную бронхорасширяющую терапию. Эти препараты врач обычно назначает в таблетированном виде на фоне продолжающейся терапии бронхорасширяющими средствами. Наиболее распространенным из этой группы является преднизолон.
Все вышеперечисленные препараты относятся к средствам базисной терапии, то есть при назначении их следует принимать регулярно в течение длительного времени. Только в этом случае можно рассчитывать на успех терапии. Хотим еще раз подчеркнуть необходимость прекращения курения как одного из факторов, значительно утяжеляющих состояние и ускоряющих прогрессирование заболевания.
При хроническом бронхите используются методы повышения неспецифической резистентности организма. С этой целью применяют адаптогены — экстракт элеутерококка по 40 капель 3 раза в день, настойку женьшеня по 30 капель 3 раза в день, настойки аралии, родиолы розовой, пантокрина в тех же дозах, сапарала по 0,05 г 3 раза в день. Действие этих препаратов многогранно: они положительно влияют на работу иммунной системы, обменные процессы, повышают устойчивость организма к неблагоприятным воздействиям внешней среды и влияниям инфекционных факторов.
 Самый древний вид спорта в мире
Самый древний вид спорта в мире Владимир Колокольцев: служба в Афгане, борьба с ОПГ и другие факты биографии главы МВД
Владимир Колокольцев: служба в Афгане, борьба с ОПГ и другие факты биографии главы МВД Чем отличается лук шалот от репчатого лука, можно ли заменять их друг другом отличий от репчатого лука
Чем отличается лук шалот от репчатого лука, можно ли заменять их друг другом отличий от репчатого лука Все бабы как бабы, а я – дура на миллион И главный вопрос: какой женщиной для этого нужно быть
Все бабы как бабы, а я – дура на миллион И главный вопрос: какой женщиной для этого нужно быть Эльза скарлетт титания. Перевооружение эльзы. Сердечные тайны Эрзы Скарлетт
Эльза скарлетт титания. Перевооружение эльзы. Сердечные тайны Эрзы Скарлетт Персонаж аниме Эльза Алая: биография, доспехи и интересные факты
Персонаж аниме Эльза Алая: биография, доспехи и интересные факты Самая популярная аниме героиня
Самая популярная аниме героиня